题目内容
【题目】为探究中和反应放热的问题进行了下列实验,回答有关问题。
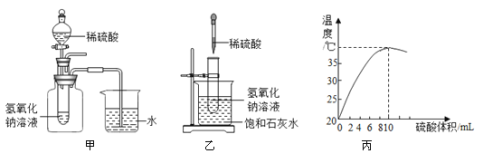
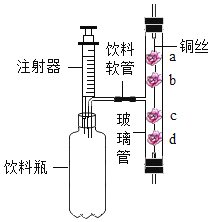
(1)实验甲,依据___现象证明该反应是放热的。
(2)实验乙,饱和石灰水出现了浑浊现象,其原因是___。
(3)丙图为向10mL10%的NaOH溶液中逐滴加入10%的稀硫酸的溶液温度数据,本实验用10%的NaOH溶液而未用NaOH固体的理由是___。
【答案】烧杯内导管口处有气泡冒出 氢氧化钠与硫酸反应放热,使饱和石灰水温度升高,造成溶解度随温度升高而减小的氢氧化钙固体析出 排除NaOH固体溶于水放热的干扰。
【解析】
(1)若实验甲中的反应是放热反应,容器内的气压会因温度升高而增大,烧杯内导管口处有气泡冒出。实验甲,依据烧杯内导管口处有气泡冒出现象证明该反应是放热的;
(2)实验乙,饱和石灰水出现了浑浊现象,其原因是:氢氧化钠与硫酸反应放热,使饱和石灰水温度升高,导致溶解度随温度升高而减小的部分氢氧化钙固体析出;
(3)本实验用10%的NaOH溶液而未用NaOH固体的理由:排除NaOH固体溶于水放热的干扰。

【题目】红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”。其标签如图所示,某化学兴趣小组对一包久置的“504双吸剂”固体样品产生浓厚的兴趣,设计实验进行探究。
品名:504双吸剂
成分:铁粉、生石灰等
(提出问题):久置固体的成分是什么?
(查阅资料):铁与氯化铁溶液在常温下发生反应:Fe+2FeCl3=3FeCl2打开固体包装观察:部分固体呈黑色,部分固体呈白色,另有少量红棕色的块状固体。
(作出猜想):久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。其中可能含有Fe2O3的依据是_____________。
(实验探究):甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
(1)取少量久置固体于试管中,滴加足量的蒸馏水,搅拌 | 固体溶解,试管外壁发烫 | 固体中一定含有______ |
(2)过滤,在滤液中滴加无色酚酞溶液 | 溶液变红色 | 固体中一定含有氢氧化钙 |
(3)取滤渣放入试管中,滴加足量的________ | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有______,一定不含氧化铁 |
(实验质疑)乙同学认为甲同学在实验中得出“一定不含氧化铁”的结论是错误的,理由是______________。你认为甲同学哪一步实验操作得出的结论也不合理:__________,理由是___________(用化学方程式表示。)
(继续探究)乙同学另取久置的固体进行实验探究:
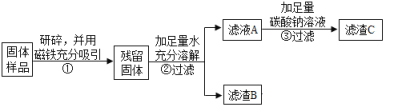
乙同学对滤渣B进行探究:
实验操作 | 实验现象 | 实验结论 |
取滤渣B于试管中,滴加足量的稀盐酸,并将气体通入澄清石灰水 | 固体逐渐消失、______有气泡冒出、______ | 固体中一定含有CaCO3和Fe2O3。写出Fe2O3和稀盐酸反应的化学方程式_______ |
(计算得出结论):如上述实验流程,乙同学现取5g久置固体研碎,用磁铁吸引,得残留固体3g,加足量水充分溶解过滤,得滤渣B的质量为1.8g。在滤液A中加足量碳酸钠溶液后过滤得滤渣C的质量为2g,通过计算后得出残留固体的成分为:__________。
【题目】(1)水是生命的源泉,也是不可缺少的资源:
![]() 自然界的水常常遭到污染,污染物中氮和磷含量过高会造成水中藻类过度繁殖,使水质恶化,人们把这种现象称之为水质富营养化
自然界的水常常遭到污染,污染物中氮和磷含量过高会造成水中藻类过度繁殖,使水质恶化,人们把这种现象称之为水质富营养化![]() 这里的“氮和磷”是指______。
这里的“氮和磷”是指______。![]() 填字母
填字母![]()
A 元素B 原子C 离子D 分子
![]() 生活中,既能降低水的硬度,又能杀菌消毒的方法是______。
生活中,既能降低水的硬度,又能杀菌消毒的方法是______。
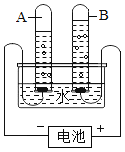
![]() 电解水的装置如图所示,管A、管B中的气体质量比是______。
电解水的装置如图所示,管A、管B中的气体质量比是______。
(2)除去下列物质中的杂质,所用试剂和操作方法正确的是_____(多选)。
选项 | 实验目的 | 实验方案 |
A | 除去NaCl溶液中的 | 加适量稀硫酸 |
B | 除去 | 将混合气体通入饱和NaHCO3溶液 |
C | 除去CaO中的 | 加水溶解,过滤 |
D | 除去 | 加适量的 |
【题目】依据下列60℃时的实验和数据完成下面小题。(已知:60℃时,NaCl和KNO3的溶解度分别为37.3g和110g)
| 序号 | ① | ② | ③ | ④ | ⑤ |
固体种类 | NaCl | NaCl | KNO3 | KNO3 | KNO3 | |
固体的质量/g | 30 | 60 | 30 | 90 | 120 | |
水的质量/g | 100 | 100 | 100 | 100 | 100 |
【1】①~⑤所得溶液属于饱和溶液的是
A. ①③B. ②④C. ②⑤D. ④⑤
【2】下列关于①~⑤所得溶液的说法不正确的是
A. 溶质质量:①<②B. 溶液质量:②<④
C. 溶质质量分数:①=③D. ⑤中溶质与溶剂的质量比为12:10
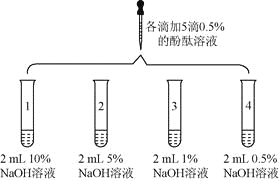
【题目】(6分)众所周知,酚酞溶液遇![]() 溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成。
【猜想与假设】
Ⅰ.红色褪去,与![]() 溶液和空气中的
溶液和空气中的![]() 反应有关。
反应有关。
Ⅱ.红色褪去,与NaOH溶液的浓度有关。
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关。
【进行实验】
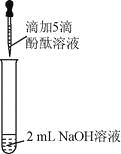
实验 | 实验操作 | 实验现象 | |
1 | 向盛有2 mL | 溶液变红 | |
2 |
| 1号试管 | |
3 | 取3支试管,分别加入2 mL水,…… | 酚酞溶液浓度/% | 浑浊程度] |
5 | 大量浑浊物 | ||
2 | 少量浑浊物 | ||
| 无浑浊物 | ||
【解释与结论】
(1)![]() 与
与![]() 反应的化学方程式为 。
反应的化学方程式为 。
(2)实验1的现象表明,猜想与假设1 (填“成立”或“不成立”)。
(3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是 。
(4)实验3的操作步骤:取3支试管,分别加入![]() 水, 。
水, 。
【反思与评价】
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为![]() ,建议选用NaOH溶液的浓度为 %。
,建议选用NaOH溶液的浓度为 %。
(6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是 。