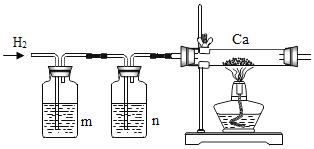
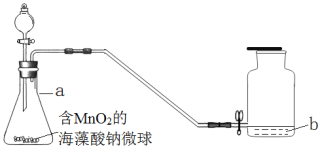
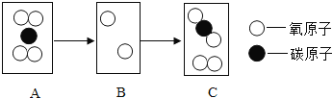
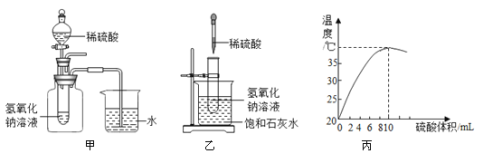
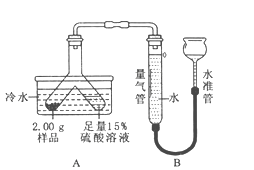
题目内容
【题目】依据下列60℃时的实验和数据完成下面小题。(已知:60℃时,NaCl和KNO3的溶解度分别为37.3g和110g)
| 序号 | ① | ② | ③ | ④ | ⑤ |
固体种类 | NaCl | NaCl | KNO3 | KNO3 | KNO3 | |
固体的质量/g | 30 | 60 | 30 | 90 | 120 | |
水的质量/g | 100 | 100 | 100 | 100 | 100 |
【1】①~⑤所得溶液属于饱和溶液的是
A. ①③B. ②④C. ②⑤D. ④⑤
【2】下列关于①~⑤所得溶液的说法不正确的是
A. 溶质质量:①<②B. 溶液质量:②<④
C. 溶质质量分数:①=③D. ⑤中溶质与溶剂的质量比为12:10
【答案】
【1】C
【2】D
【解析】
【1】60℃时,NaCl和KNO3的溶解度分别为37.3g和110g,则该温度下100g水中最多溶解NaCl和KNO3的质量分别是37.3g和110g,加入溶质的质量大于或等于37.3g和110g,能形成饱和溶液,则①~⑤所得溶液属于饱和溶液的是②⑤。故选C。
【2】60℃时,NaCl和KNO3的溶解度分别为37.3g和110g,所以①③④能完全溶解,且为不饱和溶液;②中只能溶解37.3g氯化钠形成饱和溶液,⑤中只能溶解110g KNO3形成饱和溶液。
A 溶液①中溶质的质量为30g,②中溶质的质量为37.3g,溶质质量:①<②,故A正确;
B 溶液②的质量=37.3g+100g=137.3g;溶液④的质量=90g+100g=190g,溶液质量:②<④,故B正确;
C 溶液①和③均是在100g水中溶解了30g溶质所得溶液中溶质的质量分数相等,故C正确;
D 溶液⑤是在100g水中溶解了110g硝酸钠,所以⑤中溶质与溶剂的质量比为110:100=11:10,故D错误。故选D。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案【题目】某小组同学向一定质量的石灰石中加入7.3%的稀盐酸来制取二氧化碳,测得反应过程中溶液的pH与加入的稀盐酸的关系如图1所示(已知氯化钙溶液呈中性;石灰石中的杂质不与酸反应,也不溶于水)。
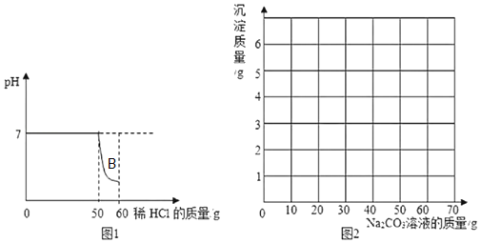
①图1中B点溶液中的溶质有_____(写化学式)。
②该小组同学能收集到的二氧化碳的质量是_____g,同时可得到CaCl2的质量为_____g。
③该小组同学把制取气体后的废液过滤,向滤液中加入10.6%的Na2CO3溶液,测得加入的Na2CO3溶液与产生的沉淀数据如下:
Na2CO3溶液质量/g | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
沉淀质量/g | 0 | 1 | n | 3 | 4 | 5 | m |
则m=_____。加入10gNa2CO3溶液时发生反应的化学方程式是_____。
④请在图2中画出向滤液中加入Na2CO3溶液时产生的沉淀的质量随加入Na2CO3溶液的变化曲线_____。