题目内容
【题目】如表为侯氏制碱法中部分物质的溶解度。
温度/℃ | 10 | 20 | 30 | 40 | |
溶解度/g | NH4Cl | 33.2 | 37.2 | 41.4 | 45.8 |
NaCl | 35.8 | 36.0 | 39.7 | 36.6 | |
NaHCO3 | 8.2 | 9.6 | 36.3 | 12.7 | |
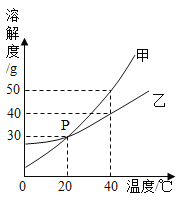
(1)在表内温度范围内溶解度随温度变化最小的是______。
(2)在侯氏制碱法的某一个工艺流程中,溶液中只有表中三种物质,在相同的温度下首先析出的质量的是____![]() 填化学式
填化学式![]() :如果要使混有少量氯化钠的氯化铵溶液析出氯化铵可采用的方法是____。
:如果要使混有少量氯化钠的氯化铵溶液析出氯化铵可采用的方法是____。
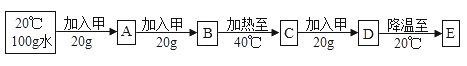
(3)40℃时将一定质量的氯化铵溶液按图进行操作:
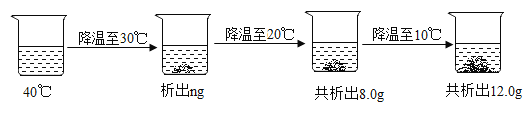
40℃时该氯化铵溶液是______![]() “饱和”或“不饱和”
“饱和”或“不饱和”![]() 溶液;图中的n的数值是______。
溶液;图中的n的数值是______。
【答案】NaCl NaHCO3 加热浓缩为氯化铵的饱和溶液后降温结晶 不饱和 3.8
【解析】
(1)由部分物质的溶解度数据可知,在表内温度范围内溶解度随温度变化最小的是NaCl;
(2)侯氏制碱法的关键步骤是:先向饱和食盐水中通入氨气,制成饱和氨盐水,氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,由于NaHCO3的溶解度远小于NH4Cl的溶解度,而生成碳酸氢钠的质量比氯化铵多,碳酸氢钠首先析出,其化学式为NaHCO3。氯化铵的溶解度受温度影响变化较大,氯化钠的溶解度受温度影响变化不大,则如果要使混有少量氯化钠的氯化铵溶液析出氯化铵,可采用的方法是先加热浓缩为氯化铵的饱和溶液,后降温结晶;
(3)20℃时氯化铵的溶解度为37.2g,10℃时氯化铵的溶解度为33.2g,析出硝酸钾的质量为12g-8g=4g,则溶液中溶剂的质量为4g/(37.2g-33.2g)×100g=100g。40℃降温到10℃,共析出硝酸钾质量12g,溶液中的溶剂质量为100g,应该析出45.8g-33.2g=12.6g,40℃时该氯化铵溶液是不饱和溶液;30℃降温到20℃,应析出41.4g-37.2g=4.2g,则图中的n的数值是12-4.2g-4g=3.8g。

【题目】自然界并不缺少镁,缺少的是发现镁的眼睛。某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
(1)第一站:初识金属镁。(①金属镁的物理性质:____(写一条);②金属镁的化学性质:镁能与氧气反应,反应的化学方程式为___.
(2)第二站:再遇金属镁。将打磨过的镁条放入稀盐酸中,反应现象是______。化学方程式为______。
(3)第三站:制备金属镁。小组同学模拟工业上从海水晒盐剩下的苦卤中提取镁,流程如下:
![]()
流程中X为________________.
(4)第四站:再探金属镁。
(提出问题)镁能否与热水反应?如果反应,产物是什么?
(相关信息)①Mg+2H2O=Mg(OH)2+H2↑②氢氧化镁在热水中能部分溶解。
实验操作 | 实验现象 | 实验结论 |
______ | _____ | 镁能与热水反应,生成氢氧化镁和氢气 |
(5)上述寻镁之旅中你收获到镁的化学性质有_______.
【题目】常温下,往盛放适量M物质的烧杯中逐渐加入N物质并充分搅拌。右下图横坐标x表示N物质的质量,纵坐标y表示烧杯中的某物理量(见下表)。下列实验与图像对应关系合理的是

M | N | y | |
A | 水 | 氧化钙 | 溶液的温度 |
B | 水 | 氢氧化钠 | 溶液的pH |
C | 饱和氯化钠溶液 | 氯化钠 | 溶液的溶质质量分数 |
D | 硫酸铜溶液 | 铁粉 | 溶液的质量 |