题目内容
【题目】现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成。
(实验步骤及数据)取该混合物粉末8.0 g放入烧杯中,将140.0g14.0%的稀硫酸分四次加入到该烧杯中,充分反应后,测得剩余固体质量的数据记录如下:
次数 | 1 | 2 | 3 | 4 |
加热稀硫酸的质量/E | 35.0 | 35.0 | 35.0 | 35.0 |
剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
通过计算(写出计算过程,结果精确到0.1%),求:
(1)该混合物粉末中铜的质量分数____________?
(2)该混合物粉末中另一金属为何种金属____________?
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少____________?
【答案】52.5% Mg 16.6%
【解析】
(1)分析表格发现,前三次每加入35g硫酸,剩余固体的质量就减少1.2g,但是第四次加入35g硫酸,剩余固体的质量减少0.2g,说明另一种金属已经全部参加反应,剩余固体就是铜,所以铜的质量为4.2g。故铜的质量分数为:![]() ×100%=52.5%。
×100%=52.5%。
(2)设该金属的相对分子质量为X,该金属为M。
以第一次加入35g硫酸为例,纯硫酸的质量是35g×14%=4.9g。
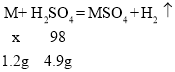
![]() 解得x=24,根据相对原子质量表,则该金属为Mg。
解得x=24,根据相对原子质量表,则该金属为Mg。
(3)设:生成MgSO4的质量为Y,H2的质量为Z。
第二次加入硫酸以后,总共加入硫酸的质量是35g×2=70g,则纯硫酸的质量是70g×14%=9.8g。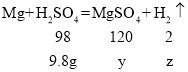
![]() 解得y=12g,z=0.2g
解得y=12g,z=0.2g
∴溶液的质量是70g+8g-5.6g-0.2g=72.2g。
∴溶质MgSO4的质量分数=![]() ×100%=16.6%。
×100%=16.6%。

【题目】潜水器中可使用过氧化钠(Na2O2)固体做供氧剂,过氧化钠固体与二氧化碳反应原理是:2Na2O2+2CO2═2Na2CO3+O2,为验证该反应产物,某兴趣小组进行如下实验探究。
(查阅资料)过氧化钠与水反应生成氢氧化钠和氧气。
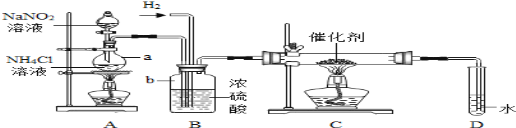
(设计实验)小组同学利用如图装置进行实(忽略稀盐酸的挥发)。
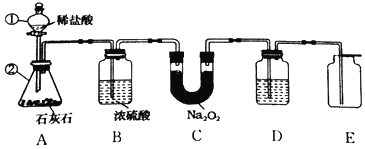
(1)装置A中标号仪器名称:①________,②________。
(2)装置A中反应的化学方程式为________。
(3)装置B的作用是________。
(4)为防止装置E收集的氧气中混有二氧化碳,装置D中盛放的试剂是________溶液。
(5)验证过氧化钠与二氧化碳反应产物
步骤 | 实验操作 | 实验现象 | 实验结论 |
① | 将带火星的木条伸入装置E中 | _____ | 产物中有氧气 |
② | 反应后取装置C中少量固体于试管中,加水完全溶解 | _____ | 固体中有未反应的过氧化钠 |
③ | 向步骤②反应后所得溶液中加入足量稀盐酸,有气体产生,将产生的气体通入足量澄清石灰水中 | _____ | 产物中有碳酸钠 |
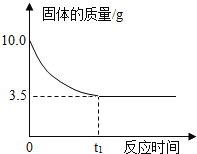
【题目】为了探究碳与某些氧化物的反应,某小组设计并进行了如下实验:取一定量烘干的木炭粉和氧化铜粉末混合均匀,在隔绝空气的条件下高温反应,将生成的气体通入澄清石灰水。下表是他们观察到的现象并作出的分析。
现象 | 分析 |
1.黑色粉末变红色 | 有单质铜固体生成 |
2.澄清石灰水变浑浊 | 有二氧化碳气体生成 |
(1)用化学方程式表示观察到的现象___________。
(2)小组的同学还推测生成物中可能有CO气体。你认为同学们的推测是否合理,并说明理由______。
(3)若要检验生成物中CO的含量,可以用M物质与CO反应之后,再进行测定。已知:M+5CO=I2+5CO2,请推测M的化学式________。
【题目】某课外小组,用大理石与盐酸反应制取二氧化碳(大理石中杂质不与盐酸反应).甲、乙、丙三同学分别进行实验,实验数据如下(烧杯的质量为25.0g).
烧杯+盐酸 | 大理石 | 充分反应后烧杯+剩余物 | |
甲 | 75.0g | 13.2g | 83.8g |
乙 | 75.0g | 16.0g | 86.6g |
丙 | 95.0g | 13.2g | 103.8g |
若甲、乙、丙三同学中有一名同学所取的大理石和盐酸恰好完全反应,请回答下列问题.
(1) 同学所取的盐酸与大理石恰好完全反应.
(2)计算大理石中碳酸钙的质量分数(计算结果精确到0.1%).