��Ŀ����
����Ŀ��ͨ����ɹ��ˮ�����ξ�ˮ���κ�ˮ�ȣ�����������ȥˮ�ֵõ����Σ������к������������ʣ���ɳ�ȣ��Ͷ��ֿ��������ʣ��Ȼ�þ���Ȼ��Ƶȣ��� [�������]��β��ܽ����������������ʺͿ��������ʣ��Ȼ�þ���Ȼ��ƣ���ȥ���Ӷ���ýϴ���ʳ�ξ��壿
[������]
20��ʱ��һЩ���ʵ��ܽ�� | OH�� | CO32�� |
Na+ | �� | �� |
Ca2+ | | �� |
Mg2+ | �� | |
[ʵ�鷽��]ijͬѧΪ���ᴿ���Σ����������ʵ�鷽��������ʵ�飮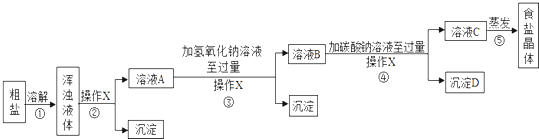
[���������]
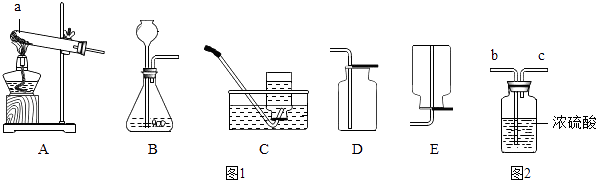
��1��ʵ�鲽��ٺ͢ڵ�Ŀ������ʵ�鲽��ۺܵ͢�Ŀ���� ��
��2��ʵ�����X�������� �� �ò�����Ҫ�õ��IJ����������ձ�����������
��3��ʵ�鲽��۵���ҪĿ�������û�ѧ����ʽ�ش𣩣��ж�����������Һ�ѹ����ķ����� ��
��4��ʵ�鲽��������ɵij���D�� �� ����д���ƣ�
��5��ʵ�鲽����������ܼ��ķ��������ý�����Һ�¶ȵķ�����ȡʳ�ξ��壬ԭ������������ʳ����Һ�Ĺ�����Ҫʹ�ò�������������
��6����ͬѧ��Ϊֻ��Ҫ������������Һ��̼������Һ������һ���Լ����ܽ����ֿ��������ʳ�ȥ������Ϊ���ַ�����ѡ����С������С�����������
��7����ͬѧ��Ϊԭʵ�鷽�������ƣ������������۵������� ��
��8��Ϊ������ԭʵ�鷽��������Ƶ�ʵ���� �� ����д�����䲿�ֵ�ʵ�����������
���𰸡�
��1����ȥ�����е����������ʣ���ȥ�����е�����������CaCl2��MgCl2
��2�����ˣ�©��
��3��MgCl2+2NaOH�TMg��OH��2��+2NaCl��ȡ��Ʒ�����������Թ��У��μӷ�̪��Һ����Һ���ɫ
��4��̼���
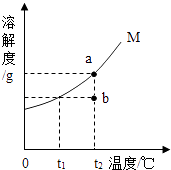
��5���Ȼ��Ƶ��ܽ�����¶�Ӱ���С��������Һ��������ֲ����ȣ����Һ�ηɽ� ?[��˼������]
��6�������У�MgCO3��Ca��OH��2��Ϊ���ֻ������һ���Լ��ͻ���һ�������������������ȫ����ȥ
��7���ڳ�ȥMgCl2��CaCl2��ͬʱ�����������µ�����NaOH��Na2CO3?[ʵ�鷽�����]
��8������ҺC����μ���ϡ���������ٲ������ݣ��μӷ�̪��Һʱ��Һ����ɫ
���������⣺��1��ͨ���ܽ⡢���˿��Ѵ����в��������ʳ�ȥ�� ͨ������ۺ͢ܣ����Գ�ȥ�����е�����������CaCl2��MgCl2����2��ʵ�����X�������ǹ��ˣ��ò�����Ҫ�õ��IJ����������ձ�����������©������3��ʵ�鲽��۵���ҪĿ���dz�ȥ�Ȼ�þ���������ƺ��Ȼ�þ��Ӧ����������þ�������Ȼ��ƣ���Ӧ�Ļ�ѧ����ʽΪ��MgCl2+2NaOH�TMg��OH��2��+2NaCl��
�ж�����������Һ�ѹ����ķ����ǣ�ȡ��Ʒ�����������Թ��У��μӷ�̪��Һ����Һ���ɫ����4��ʵ�鲽��������ɵij���D��̼��ƣ���5��ʵ�鲽����������ܼ��ķ��������ý�����Һ�¶ȵķ�����ȡʳ�ξ��壬ԭ�����Ȼ��Ƶ��ܽ�����¶�Ӱ���С��
������ʳ����Һ�Ĺ�����Ҫʹ�ò������������ǽ�����Һ��������ֲ����ȣ����Һ�ηɽ�����6�����ַ��������У���ΪMgCO3��Ca��OH��2��Ϊ���ֻ������һ���Լ��ͻ���һ�������������������ȫ����ȥ��
���Դ��ǣ������У�MgCO3��Ca��OH��2��Ϊ���ֻ������һ���Լ��ͻ���һ�������������������ȫ����ȥ����7�������������۵������ǣ��ڳ�ȥMgCl2��CaCl2��ͬʱ�����������µ�����NaOH��Na2CO3 ��
����ڳ�ȥMgCl2��CaCl2��ͬʱ�����������µ�����NaOH��Na2CO3 �� ��8����Ƶ�ʵ���ǣ�����ҺC����μ���ϡ���������ٲ������ݣ��μӷ�̪��Һʱ��Һ����ɫ��
���Դ��ǣ���1����ȥ�����е����������ʣ���ȥ�����е�����������CaCl2��MgCl2����2�����ˣ�©������3��MgCl2+2NaOH�TMg��OH��2��+2NaCl��ȡ��Ʒ�����������Թ��У��μӷ�̪��Һ����Һ���ɫ����4��̼��ƣ���5���Ȼ��Ƶ��ܽ�����¶�Ӱ���С��������Һ��������ֲ����ȣ����Һ�ηɽ�����6�������У�MgCO3��Ca��OH��2��Ϊ���ֻ������һ���Լ��ͻ���һ�������������������ȫ����ȥ����7���ڳ�ȥMgCl2��CaCl2��ͬʱ�����������µ�����NaOH��Na2CO3����8������ҺC����μ���ϡ���������ٲ������ݣ��μӷ�̪��Һʱ��Һ����ɫ��
�����㾫�������ù��˲�����ע�����������������ע���������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪���˲���ע�������һ���������͡������������˺���Һ��Ȼ���ǵĿ���ԭ����:�ٳн���Һ���ձ����ɾ����㵹Һ��ʱҺ�������ֽ��Ե����ֽ��������ע��㣺1���ڼ��ȹ����У��ò��������Ͻ���2����Һ��ӽ����ɣ�����ֽ϶������壩ʱֹͣ���ȣ��������Ƚ�ʣ��ˮ�����������Ա�����������ȶ��Ž�������3���ȵ�������Ҫ������ǯ��ȡ���ȵ�������������������ʵ��̨�ϣ�Ҫ����ʯ������

 ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д� С�����ϵ�д�
С�����ϵ�д�