题目内容
高速电气化铁路的建设需要大量的铁矿石。某化学兴趣小组取得铁路建设所用的赤铁矿石样品(含Fe2O3和杂质,杂质不溶于水且不参加化学反应)20g,将其置于烧杯中,向其中加入84g稀盐酸,反应原理为:Fe2O3+6HCl=2FeCl3+3H2O,二者恰好反应,反应后过滤,得到滤渣4g。
求:(1)赤铁矿石中Fe2O3的质量分数;
(2)滤液中溶质的质量分数。
求:(1)赤铁矿石中Fe2O3的质量分数;
(2)滤液中溶质的质量分数。
(1)80% (2)32.5%
试题分析:(1)赤铁矿石中Fe2O3的质量分数为
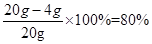 ;
;(2)设反应生成氯化铁质量为
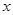 ,则
,则Fe2O3+6HCl=2FeCl3+3H2O
160 325
20g-4g
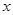
有
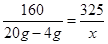 ,解得
,解得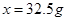
溶液质量为:84g+20g-4g=100g
则滤液中溶质的质量分数为
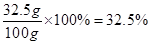
则滤液中溶质的质量分数为32.5%
点评:这是化学反应联系方程式的计算题,这种题目是每年中考的压轴题,必考题,这类题目的难点在于理顺题目中的已知条件。

练习册系列答案
相关题目


 水+氧气
水+氧气 

