题目内容
某化学兴趣小组的同学在实验室配制溶质质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。下图表示用该氢氧化钠溶液与10 g某稀盐酸发生反应时溶液温度的变化情况。试计算稀盐酸中溶质的质量分数。

14.6%
试题分析:根据氢氧化钠与盐酸的反应,结合图示进行分析,由于盐酸与氢氧化钠反应会放出热量,故反应过程中,有温度的升高,且当二者恰好完全反应时,放出的热量最多,即温度达到最高;然后继续加入氢氧化钠时,由于不再反应,故无热量放出,且由于氢氧化钠溶液的温度较低,故溶液混合后,会导致温度下降;由此可知,与10g稀盐酸完全反应时,用掉的氢氧化钠的质量为20g,再根据二者反应的化学方程式,以及其中的物质间的质量比,即可求得盐酸的溶质质量分数。
解,设10g稀盐酸中含HCl的质量为x
HCl + NaOH =" NaCl" + H2O
36.5 40
x 20g×8%
36.5:40=x:(20g×8%)
解得,x=1.46g
则稀盐酸中溶质的质量分数=
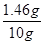 ×100%="14.6%"
×100%="14.6%" 答:稀盐酸中溶质的质量分数为14.6% 。
点评:此题是关于化学方程式及溶质质量分数的计算题,要求学生有较强的识图能力和数据分析能力;解题的关键是,根据图示,找出与盐酸恰好完全反应的氢氧化钠的质量;然后再根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。

练习册系列答案
相关题目


