题目内容
(3分)将碳酸钠和硫酸钠的固体混合物6g,放入烧杯中,再加入一定量的稀硫酸,在一定时间内恰好完全反应,无固体剩余,所得溶液溶质质量分数为19.5%,反应的时间(t)和烧杯及其所盛物质总质量(m)的关系如右图所示:

(1)生成气体的质量为 。
(2)求所加稀硫酸的溶质质质量分数。

(1)生成气体的质量为 。
(2)求所加稀硫酸的溶质质质量分数。
(1)2.2 g (1分) (2)13.5 %
试题分析:(1)向碳酸钠和硫酸钠的混合物中加入稀硫酸,碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,由于反应放出气体二氧化碳而使烧杯内所盛物质的总质量减小,且质量减小的值即反应放出的二氧化碳的质量;故根据烧杯中所盛物质的质量曲线可知,反应放出二氧化碳的质量=62.2g-60.0g=2.2g。
(2)要计算所加稀硫酸的溶质质量分数,需要知道所加稀硫酸的质量和稀硫酸中硫酸的质量;参加反应的硫酸的质量可由反应放出二氧化碳气体的质量求得;而要求得所加稀硫酸的质量,可根据质量守恒定律求得,即所加稀硫酸的质量=反应后所得溶液质量+放出气体二氧化碳的质量-固体混合物的质量。
解:设原混合物中碳酸钠的质量为x,参加反应的硫酸的质量为y,生成的硫酸钠的质量为z。
Na2CO3 + H2SO4 = Na2SO4 + CO2↑+ H2O
106 98 142 44
x y z 2.2 g
 解之得 x=5.3g
解之得 x=5.3g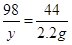 解之得y=4.9g
解之得y=4.9g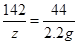 解之得z=7.1g
解之得z=7.1g根据题意可知,反应后所得溶液的溶质为硫酸钠,且溶质质量分数为19.5%
设所加稀硫酸的质量为m,则有
 ×100% =" 19.5" %解之得m="36.2" g
×100% =" 19.5" %解之得m="36.2" g则所加稀硫酸的溶质质量分数为:
 ×100% =" 13.5" %
×100% =" 13.5" %答:所加稀硫酸的溶质质量分数为13.5%。
点评:此题是关于化学方程式的计算题,主要是利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力,解题的关键是找出相关的化学反应,并依据已知量对未知的应求量进行求解计算。

练习册系列答案
相关题目

