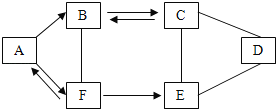
题目内容
【题目】氯化钠(NaCl) 和硝酸钾 (KNO3) 在不同温度时的溶解度如下表,20℃时甲乙两个烧杯中各有100g水,分别都加入质量为m的氯化钠和硝酸钾固体,充分溶解后如图所示:
温度(℃) | 10 | 20 | 40 | 60 | 80 | |
溶解 度/g | KNO3 | 20.9 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.8 | 36 | 36.6 | 37.3 | 38.4 | |
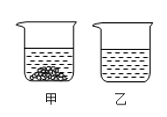
(1)氯化钠和硝酸钾两种物质中,溶解度受温度影响较大的是_____________。
(2)甲中溶解的物质是__________。
(3)常温下配制100g氯化钠的饱和溶液,所需的玻璃仪器有___________。
(4)下列说法正确的是___________
A 若将甲、乙烧杯中的溶液都升温到40℃,所得溶液均不饱和
B 若将甲、乙烧杯中的溶液都降温到10℃,可能都会有固体析出
C 若向甲中加入20g水,则甲中的溶液一定变为不饱和
D 硝酸钾中混有少量的氯化钠,可采用蒸发结晶的方法提纯硝酸钾
【答案】硝酸钾 硝酸钾 量筒、玻璃棒、烧杯 ABC
【解析】
(1)分析表格中的数据可以知道硝酸钾溶解度受温度影响较大;
(2)20℃时,硝酸钾的溶解度小于氯化钠,故分别都加入质量为m的固体,硝酸钾中有固体剩余,甲中溶解的物质是硝酸钾;
(3)常温下配制100g氯化钠的饱和溶液,所需的玻璃仪器有量筒、玻璃棒、烧杯;
(4)根据试题可知,甲在20摄氏度有晶体析出,乙没有;结合溶解度分析可知应该为:31.6g>固体质量>36g
A、若将甲、乙烧杯中的溶液都升温到40℃,乙溶液是不饱和,甲溶液也是不饱和,选项A正确;
B、若将甲、乙烧杯中的溶液都降温到10℃,甲中本身就饱和故降温一定有固体析出,乙溶液可能有固体析出,选项B正确;
C、若向甲中加入20g水,按照溶质质量最多为36g计算,则甲中的溶液的质量分数为![]() ,所以甲一定还不饱和,选项C正确;
,所以甲一定还不饱和,选项C正确;
D、硝酸钾中混有少量的氯化钠,可采用降温结晶的方法提纯硝酸钾,选项D不正确;
故选ABC。

 名题金卷系列答案
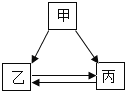
名题金卷系列答案【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_____________。
【查阅资料】CaC12 滚液显中性
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想I:只有CaC12 猜想II:有__________
猜想III:有CaC12和Ca(OH)2 猜想IV:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是_________________。
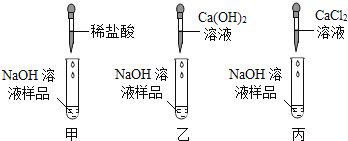
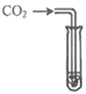
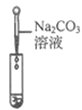
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | ____________ | __________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【得出结论】通过探究,全班同学一致确定猜想III是正确的。
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因____________。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外.还需要考虑_______。
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是____________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | ________,白色沉淀________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |