题目内容
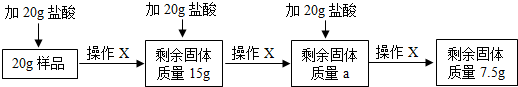
实验室新到的一批大理石在跟盐酸反应时的速度太慢,为测定这批大理石中的CaCO3的质量分数,取20克大理石样品与60克盐酸分三次加入进行反应(杂质不与盐酸反应)进行如下实验,并取得如下数据(反应方程式:2HCl+CaCO3═CaCl2+H2O+CO2↑)
求算(1)在这反应中得到二氧化碳的质量是多少?
(2)计算这批大理石中的CaCO3的质量分数是多少?
| 实验 | 1 | 2 | 3 |
| 加入的盐酸质量 | 20克 | 20克 | 20克 |
| 测得剩余物质的质量 | 37.8克 | 55.6克 | 75.6克 |
(2)计算这批大理石中的CaCO3的质量分数是多少?
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)依据质量守恒定律的有关知识解决即可;
(2)依据得到的二氧化碳的质量利用反应的方程式对碳酸钙的质量计算即可;
(2)依据得到的二氧化碳的质量利用反应的方程式对碳酸钙的质量计算即可;
解答:解:(1)由质量守恒定律可知生成二氧化碳的质量=20g+20g+20g+20g-75.6g=4.4g;
(2)由第一次加入20g盐酸后剩余固体的质量是37.8g,所以20g盐酸能够生成二氧化碳的质量为20g+20g-37.8g=2.2g,而第三次加入20g盐酸后没有生成二氧化碳,则证明碳酸钙已经完全反应;
设反应的碳酸钙的质量为x
2HCl+CaCO3═CaCl2+H2O+CO2↑
100 44
x 4.4g
=
x=10g
则这批大理石中的CaCO3的质量分数是
×100%=50g
答:(1)在这反应中得到二氧化碳的质量是4.4g;(2)计算这批大理石中的CaCO3的质量分数是50%.
(2)由第一次加入20g盐酸后剩余固体的质量是37.8g,所以20g盐酸能够生成二氧化碳的质量为20g+20g-37.8g=2.2g,而第三次加入20g盐酸后没有生成二氧化碳,则证明碳酸钙已经完全反应;
设反应的碳酸钙的质量为x
2HCl+CaCO3═CaCl2+H2O+CO2↑
100 44
x 4.4g
| 100 |
| x |
| 44 |
| 4.4g |
x=10g
则这批大理石中的CaCO3的质量分数是
| 10g |
| 20g |
答:(1)在这反应中得到二氧化碳的质量是4.4g;(2)计算这批大理石中的CaCO3的质量分数是50%.
点评:本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.

练习册系列答案
相关题目
某同学在确定一种气体的实验室制法时,不需要考虑的是( )
| A、反应所需条件和药品的状态 |
| B、实验装置及原理 |
| C、气体的验证 |
| D、气体的用途 |