题目内容
某兴趣小组的同学为分析一种石灰石样品中碳酸钙的质量分数,取20g样品放入烧杯,把60g稀盐酸分三次加入烧杯,使其充分反应(样品中所含杂质既不溶于水也不与稀盐酸反应),实验流程及数据如下(所有实验数据都不包括烧杯的质量,且不考虑H2O和HCl的挥发;操作X包括搅拌、过滤、洗涤、干燥、称量):
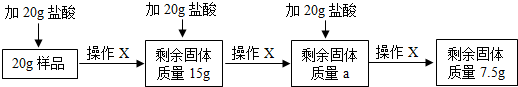
请回答:
(1)a= ;
(2)样品中碳酸钙的质量分数为 ;
(3)计算所用稀盐酸中溶质的质量分数(写出计算过程).

请回答:
(1)a=
(2)样品中碳酸钙的质量分数为
(3)计算所用稀盐酸中溶质的质量分数(写出计算过程).
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)据各步反应消耗碳酸钙的质量分析a的数值;
(2)依据最终剩余的固体质量计算碳酸钙的质量分数;
(3)依据数据分析可知20g盐酸能与5g碳酸钙恰好反应以及化学方程式的计算分析解答.
(2)依据最终剩余的固体质量计算碳酸钙的质量分数;
(3)依据数据分析可知20g盐酸能与5g碳酸钙恰好反应以及化学方程式的计算分析解答.
解答:解:(1)从第一次加入20g盐酸后固体变为15g,可知每20g盐酸能消耗5g碳酸钙,所以a值应该为15g-5g=10g,第三次加入20g盐酸后剩余固体是7.5g,不是10g-5g=5g,所以剩余的固体即为杂质;
故答案为:10g;
(2)杂质的质量为7.5g,故碳酸钙的质量分数为:
×100%=62.5%;
故答案为:62.5%;
(3)设与10克碳酸钙反应的HCl的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73
5g x
=
x=3.65g
所以稀盐酸中溶质的质量分数为:
×100%=18.25%.
答:用稀盐酸中溶质的质量分数我18.25%.
故答案为:10g;
(2)杂质的质量为7.5g,故碳酸钙的质量分数为:
| 20g-7.5g |
| 20g |
故答案为:62.5%;
(3)设与10克碳酸钙反应的HCl的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73
5g x
| 100 |
| 73 |
| 5g |
| x |
x=3.65g
所以稀盐酸中溶质的质量分数为:
| 3.65g |
| 20g |
答:用稀盐酸中溶质的质量分数我18.25%.
点评:分析实验所记录的数据时,注意数据变化量间的规律,利用变化规律判断完全反应时所涉及物质的质量.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
下列化学方程式符合题意且书写正确的是( )
| A、用硫酸除铁锈:FeO+H2SO4═FeSO4+H2O |
| B、正常雨水的pH约为5.6的原因:CO2+H2O═H2CO3 |
| C、医疗上用碱性物质中和过多胃酸:NaOH+HCl═NaCl+H2O |
| D、除去铜粉中少量的铁粉:2Fe+6HCl═2FeCl3+3H2↑ |

