题目内容
实验室常利用图1装置完成气体制备及性质实验.请回答
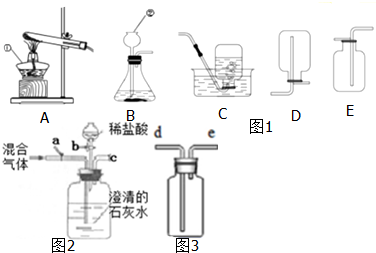
(1)指出编号仪器的名称:① ,② .
(2)以上 (从A-E中选择)装置有一处明显的错误,请加以改正 .利用改正后的装置继续完成后面的实验.
(3)欲使用高锰酸钾制取氧气,应选择的发生装置是 (填字母),反应原理用化学方程式表示为 ;为防止高锰酸钾粉末进入导管,应采取的措施是 .
(4)若使用过氧化氢制氧气,应该选择的装置是 ,反应原理用化学反应方程式表示 .
(5)能使用C装置收集氧气,原因是 .
验满方法: .当实验结束时,应先从水槽中移出导气管,再熄灭酒精灯,原因是 .
(6)如图2所示,将CO2和CO的混合气体通过此装置(液体药品均足量),实验开始时关闭活塞b,打开活塞a,广口瓶中观察到的现象是 ,此时从导管c逸出的气体主要是 .一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时逸出的气体主要是 ,反应原理用化学方程式表示为 ,欲收集该气体,应选择的装置是 (填字母).验满的方法是 .
(7)如图3所示,若使用此装置排空气法收集H2 管进气,若将此集气瓶中装满水,使用排水法收集H2 管进气.

(1)指出编号仪器的名称:①
(2)以上
(3)欲使用高锰酸钾制取氧气,应选择的发生装置是
(4)若使用过氧化氢制氧气,应该选择的装置是
(5)能使用C装置收集氧气,原因是
验满方法:
(6)如图2所示,将CO2和CO的混合气体通过此装置(液体药品均足量),实验开始时关闭活塞b,打开活塞a,广口瓶中观察到的现象是
(7)如图3所示,若使用此装置排空气法收集H2
考点:常用气体的发生装置和收集装置与选取方法,实验室制取氧气的反应原理,氧气的检验和验满,制取氧气的操作步骤和注意点,二氧化碳的实验室制法,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)从仪器的图形和用途去分析解答;
(2)从A装置中,伸入试管内的导气管不宜过长,否则会导致试管内的空气不易排出,导致收集的氧气不纯去分析解答;
(3)从用加热高锰酸钾的方法制取氧气,在生成氧气的同时,还有锰酸钾和二氧化锰生成,反应需要加热,制取氧气时,由于高锰酸钾粉末会随着氧气流进入导管继续进入水槽,使水槽中的水变红,为避免这一现象的发生,往往会要试管口放一棉花团去分析解答;
(4)从过氧化氢在二氧化锰催化作用下制取氧气,生成氧气的同时还有水生成,反应不需加热去分析解答;
(5)从由于氧气不易溶于水,用排水法收集一氧气,当瓶内充满氧气后,瓶内的水会排干净,会看到瓶口有大量气泡冒出;实验结束时,如果先熄灭酒精灯,水槽内的水就会被顺着导管压到试管内,可能使试管由于受热不均从而炸裂去分析解答;
(6)从实验开始时关闭活塞b,打开活塞a,二氧化碳和石灰水反应生成不溶于水的碳酸钙,所以广口瓶中会看到石灰水变浑浊;混合气体的二氧化碳被石灰水吸收,此时剩余的气体主要是CO;一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时是碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳.其反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;逸出的气体主要是二氧化碳去分析解答;
(7)从氢气的密度比空气小,如果从d端进入,氢气就会顺着e管跑出;如果从e管进入,则氢气浮在上方,氢气由上而下充满集气瓶;如果集气瓶内充满水,则氢气应从e管进入,集气瓶中的水会被氢气逐渐压出,当水排净时,瓶内充满氢气去分析解答;
(2)从A装置中,伸入试管内的导气管不宜过长,否则会导致试管内的空气不易排出,导致收集的氧气不纯去分析解答;
(3)从用加热高锰酸钾的方法制取氧气,在生成氧气的同时,还有锰酸钾和二氧化锰生成,反应需要加热,制取氧气时,由于高锰酸钾粉末会随着氧气流进入导管继续进入水槽,使水槽中的水变红,为避免这一现象的发生,往往会要试管口放一棉花团去分析解答;
(4)从过氧化氢在二氧化锰催化作用下制取氧气,生成氧气的同时还有水生成,反应不需加热去分析解答;
(5)从由于氧气不易溶于水,用排水法收集一氧气,当瓶内充满氧气后,瓶内的水会排干净,会看到瓶口有大量气泡冒出;实验结束时,如果先熄灭酒精灯,水槽内的水就会被顺着导管压到试管内,可能使试管由于受热不均从而炸裂去分析解答;
(6)从实验开始时关闭活塞b,打开活塞a,二氧化碳和石灰水反应生成不溶于水的碳酸钙,所以广口瓶中会看到石灰水变浑浊;混合气体的二氧化碳被石灰水吸收,此时剩余的气体主要是CO;一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时是碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳.其反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;逸出的气体主要是二氧化碳去分析解答;
(7)从氢气的密度比空气小,如果从d端进入,氢气就会顺着e管跑出;如果从e管进入,则氢气浮在上方,氢气由上而下充满集气瓶;如果集气瓶内充满水,则氢气应从e管进入,集气瓶中的水会被氢气逐渐压出,当水排净时,瓶内充满氢气去分析解答;
解答:解:(1)由仪器的图形和用途可知:①为酒精灯,②为长颈漏斗;故答案为:酒精灯 长颈漏斗;
(2)A装置中,伸入试管内的导气管不宜过长,否则会导致试管内的空气不易排出,导致收集的氧气不纯;故答案为:A 伸入试管内的导气管稍稍露出橡皮塞即可;
(3)用加热高锰酸钾的方法制取氧气,在生成氧气的同时,还有锰酸钾和二氧化锰生成,所以化学方程式为:2KMnO4
K2MnO4+MnO2+O2↑;由于反应需要加热,所以发生装置选择A;制取氧气时,由于高锰酸钾粉末会随着氧气流进入导管继续进入水槽,使水槽中的水变红,为避免这一现象的发生,往往会要试管口放一棉花团.
故答案为:A 2KMnO4
K2MnO4+MnO2+O2↑ 试管口放一棉花团;
(4)过氧化氢在二氧化锰催化作用下制取氧气,生成氧气的同时还有水生成,二氧化锰在反应前后质量和化学性质都没有改变,只是加快了过氧化氢反应生成氧气的速率,故二氧化锰的作用是起了催化剂的作用也就是催化作用.所以二氧化锰就应该作为反应条件写在等号的上方,故化学方程式为:2H2O2
2H2O+O2↑,由于反应不需加热,所以发生装置应选择B;故答案为:B 2H2O2
2H2O+O2↑;
(5)由于氧气不易溶于水,所以氧气可用排水法收集;用排水法收集一氧气,当瓶内充满氧气后,瓶内的水会排干净,会看到瓶口有大量气泡冒出;实验结束时,如果先熄灭酒精灯,停止加热,再把导管移出水槽.这样随着试管的温度越来越低,试管内的气体体积就越来越小,内部大气压变小,在外部大气压的作用下,水槽内的水就会被顺着导管压到试管内,可能使试管由于受热不均从而炸裂;故答案为:氧气不易溶于水 当瓶口有大量气泡逸出时 防止水槽内的水倒流,引起试管底部炸裂;
(6)实验开始时关闭活塞b,打开活塞a,二氧化碳和石灰水反应生成不溶于水的碳酸钙,所以广口瓶中会看到石灰水变浑浊;混合气体的二氧化碳被石灰水吸收,此时剩余的气体主要是CO;一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时是碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳.其反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;逸出的气体主要是二氧化碳;由于二氧化碳能溶于水且密度比空气大,所以只能用向上排空气法收集;由于二氧化碳密度比空气大且不能支持燃烧,所以把燃着的木条放在集气瓶口,如果熄灭,证明已满;
故答案为:石灰水变浑浊 一氧化碳 二氧化碳 E 燃着的木条放在集气瓶口,如果熄灭,证明已满;
(7)由于氢气的密度比空气小,如果从d端进入,氢气就会顺着e管跑出;如果从e管进入,则氢气浮在上方,氢气由上而下充满集气瓶;如果集气瓶内充满水,则氢气应从e管进入,集气瓶中的水会被氢气逐渐压出,当水排净时,瓶内充满氢气;故答案为:e e.
(2)A装置中,伸入试管内的导气管不宜过长,否则会导致试管内的空气不易排出,导致收集的氧气不纯;故答案为:A 伸入试管内的导气管稍稍露出橡皮塞即可;
(3)用加热高锰酸钾的方法制取氧气,在生成氧气的同时,还有锰酸钾和二氧化锰生成,所以化学方程式为:2KMnO4
| ||
故答案为:A 2KMnO4
| ||
(4)过氧化氢在二氧化锰催化作用下制取氧气,生成氧气的同时还有水生成,二氧化锰在反应前后质量和化学性质都没有改变,只是加快了过氧化氢反应生成氧气的速率,故二氧化锰的作用是起了催化剂的作用也就是催化作用.所以二氧化锰就应该作为反应条件写在等号的上方,故化学方程式为:2H2O2
| ||
| ||
(5)由于氧气不易溶于水,所以氧气可用排水法收集;用排水法收集一氧气,当瓶内充满氧气后,瓶内的水会排干净,会看到瓶口有大量气泡冒出;实验结束时,如果先熄灭酒精灯,停止加热,再把导管移出水槽.这样随着试管的温度越来越低,试管内的气体体积就越来越小,内部大气压变小,在外部大气压的作用下,水槽内的水就会被顺着导管压到试管内,可能使试管由于受热不均从而炸裂;故答案为:氧气不易溶于水 当瓶口有大量气泡逸出时 防止水槽内的水倒流,引起试管底部炸裂;
(6)实验开始时关闭活塞b,打开活塞a,二氧化碳和石灰水反应生成不溶于水的碳酸钙,所以广口瓶中会看到石灰水变浑浊;混合气体的二氧化碳被石灰水吸收,此时剩余的气体主要是CO;一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时是碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳.其反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;逸出的气体主要是二氧化碳;由于二氧化碳能溶于水且密度比空气大,所以只能用向上排空气法收集;由于二氧化碳密度比空气大且不能支持燃烧,所以把燃着的木条放在集气瓶口,如果熄灭,证明已满;
故答案为:石灰水变浑浊 一氧化碳 二氧化碳 E 燃着的木条放在集气瓶口,如果熄灭,证明已满;
(7)由于氢气的密度比空气小,如果从d端进入,氢气就会顺着e管跑出;如果从e管进入,则氢气浮在上方,氢气由上而下充满集气瓶;如果集气瓶内充满水,则氢气应从e管进入,集气瓶中的水会被氢气逐渐压出,当水排净时,瓶内充满氢气;故答案为:e e.
点评:用“万用瓶”收集气体时,如果气体的密度比空气大,则“长进短出”;否则,“短进长出”.

练习册系列答案
相关题目


 取少量碳酸氢钠(NaHCO3)粉末,用如图装置进行实验,充分加热后发现:大试管中管口有水珠出现,管底有白色固体残留,小试管中澄清石灰水变浑浊,完全反应后,取残留固体溶于水配成溶液,往该溶液中滴加CaCl2溶液,有白色沉淀生成.
取少量碳酸氢钠(NaHCO3)粉末,用如图装置进行实验,充分加热后发现:大试管中管口有水珠出现,管底有白色固体残留,小试管中澄清石灰水变浑浊,完全反应后,取残留固体溶于水配成溶液,往该溶液中滴加CaCl2溶液,有白色沉淀生成.