题目内容
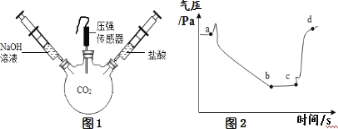
【题目】如图所示,某化学小组在白色点滴板上进行的有关“碱的化学性质“的探究实验。
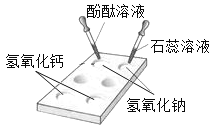
(1)使用白色点滴板进行实验的优点是________________(答一点);
(2)氢氧化钠溶液和氢氧化钙溶液都能使无色的酚酞试液变成____色,
是因为在不同碱的溶液中都含有相同的________离子;
(3)写出氢氧化钠与下列物质反应的化学方程式:
①与二氧化碳反应: _______________;
②与硫酸溶液反应: _________________;
③与硫酸铜溶液反应: _________________;
(4)请写出氢氧化钙的一种合理用途为__________________。
【答案】节约药品可减少对环境的污染,可同时完成多个实验,便于观察实验现象等 红 氢氧根(或OH–) 2NaOH+CO2=Na2CO3+H2O 2NaOH+H2SO4=Na2SO4+2H2O 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ 降低土壤酸性、配制波尔多液等
【解析】
(1)使用白色点滴板进行实验的优点是节约药品可减少对环境的污染,可同时完成多个实验,便于观察实验现象等(合理即可);
(2)氢氧化钠和氢氧化钙的水溶液呈碱性,都能使无色的酚酞试液变成红色;是因为在不同碱的溶液中都含有相同的氢氧根离子(OH–);
(3)①氢氧化钠溶液与二氧化碳反应生成碳酸钠和水,反应的化学方程式为:CO2+2NaOH═Na2CO3+H2O。
②氢氧化钠溶液与稀硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O。
③氢氧化钠与硫酸铜溶液反应生成氢氧化铜蓝色沉淀和硫酸钠,反应的化学方程式为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓。
(4)氢氧化钙的合理用途为降低土壤酸性、配制波尔多液等。