��Ŀ����
����Ŀ��M�������г����Ľ�����MSO4��Һ����ɫҺ�壬ij��ѧ��ȤС���ͬѧ��̽��M��ͭ�����Ļ��˳�����������һ���������̽�����
��1����������⡿M��ͭ�����Ľ������˳���������ģ� ����������衿С���IJ�����Al��Cu��M��Сǿ�IJ�����Al��M��Cu����IJ����� ��
��2���������ʵ��һ��С��ȡM˿��ͭ˿����˿�ͱ��Ϊ�١��ڡ��۵�3֧�Թܣ����������ʵ�飨�Թ��о�ʢ�������ͬ��������������Ҳ��ͬ��ϡ���ᣩ��
ʵ����� | M˿�����Թܢ��� | ͭ˿�����Թܢ��� | ��˿�����Թܢ��� | ʵ����� |
�տ�ʼ������ | ���������ݲ��� | ������ | ������ | M��Cu�� |
�����Ӻ������ | ���������ݲ��� | ������ | �д������ݲ��� |
��3������������ͬѧ�Ƕ�ͬһʵ��ó����ֲ�ͬ���۵�������������ۣ�������ʵ��տ�ʼʱ�Թܢ��������ݲ�����ԭ��ԭ���� ��
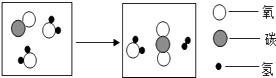
��4���������ʵ�����Ϊ�˽�һ��̽�����ֽ����Ļ��˳��ͬѧ��ȡ��ϸ��ͬ����ĥ�ɾ���M˿����˿�������Һ���ֽ�������ͼ��ʾ��ʵ�飺 
���Թ����й۲쵽�������� ��
���Թܱ��з�Ӧ�Ļ�ѧ����ʽΪ ��
��5������������ͬѧ�Ǿ����ۺ���Ϊ��ʵ������Ż���ȥ���Թ������Թܱ�ţ��е�ʵ�飬Ҳ���Եó���ȷ�Ľ��ۣ� ����������ۡ�ͨ������ʵ�飬ͬѧ�ǵó������ֽ����Ļ��˳��
��6���������뷴˼��ʵ�������ͬѧ�Ƕ�ʵ����̽��������·�˼�� ��Ӱ��������ᷴӦ���ʿ��������أ��������Ӧ�Ľ�������������⣬��������дһ�֣�
��̽���������˳��ʱ����������ʵ�����Ѿ��õ������ַ����⣬�����Ը��������жϣ���дһ�֣�
���𰸡�
��1��M��Al��Cu
��2��M��Al��Al��M��Cu
��3����������һ������Ĥ
��4��M�������һ���ɫ���ʣ�2Al+3CuSO4=Al2��SO4��3+3Cu
��5����
��6����Ӧ��Ӵ�������¶ȣ���������Ӧ�ľ��ҳ̶�
���������⣺��������⡿ͨ������С����Сǿͬѧ�IJ����֪���ҵIJ�����M��Al��Cu���������ʵ��һ������Խ���ã����ᷴӦ���������ķ�ӦԽ���ң�����
ʵ����� | M˿�����Թܢ��� | ͭ˿�����Թܢ��� | ��˿�����Թܢ��� | ʵ����� |
�տ�ʼ������ | ���������ݲ��� | ������ | ������ | M��Cu��M��Al |
�����Ӻ������ | ���������ݲ��� | ������ | �д������ݲ��� | Al��M��Cu |
�������������Ϳ����е�������Ӧ���������ܵ���������Ĥ������ʵ��տ�ʼʱ�Թܢ��������ݲ�����ԭ���ǣ���������һ������Ĥ��
�������ʵ�������1��M�Ľ�����Դ���ͭ�Ľ�����ԣ������Թ����й۲쵽�������ǣ�M�������һ���ɫ���ʣ���2����������ͭ��Ӧ������������ͭ����ѧ����ʽΪ��2Al+3CuSO4=Al2��SO4��3+3Cu��
������������ʵ�������֤����M���ã���ʵ�����֤��M��ͭ���ã��������ֽ����Ļ��˳����Al��M��Cu������ȥ���Թܱ��е�ʵ�飬Ҳ���Եó���ȷ�Ľ��ۣ�
�������뷴˼����1��Ӱ��������ᷴӦ���ʿ��������أ��������Ӧ�Ľ�������������⣬���з�Ӧ��Ӵ�������¶ȵȣ���2�����������ᡢ�Ρ����������ʷ�Ӧ�����Գ�������ʵ�����Ѿ��õ������ַ����⣬�����Ը�����������Ӧ�ľ��ҳ̶Ƚ����жϣ�
�ʴ�Ϊ����������⡿M��Al��Cu��
�������ʵ��һ��
ʵ����� | M˿�����Թܢ��� | ͭ˿�����Թܢ��� | ��˿�����Թܢ��� | ʵ����� |
M��Al | ||||
Al��M��Cu |
������������������һ������Ĥ��
�������ʵ�������M�������һ���ɫ���ʣ���2Al+3CuSO4=Al2��SO4��3+3Cu��
��������������
�������뷴˼���ٷ�Ӧ��Ӵ�������¶ȵȣ�����������Ӧ�ľ��ҳ̶ȣ�
��������⡿�����������ֲ����ƶϵ����ֲ��룻
�������ʵ��һ�����ݽ������ᷴӦ�ľ��ҳ̶Ƚ��з�����
�����������������Ϳ����е�������Ӧ���������ܵ���������Ĥ���з�����
�������ʵ������ٸ���M�Ľ�����Դ���ͭ�Ľ�����Խ��з������ڸ�����������ͭ��Ӧ������������ͭ���з�����
�������������ݼס��ҡ�������ʵ��ó��Ľ������˳����з�����
�������뷴˼���ٸ���Ӱ��������ᷴӦ���ʿ��������أ��������Ӧ�Ľ�������������⣬���з�Ӧ��Ӵ�������¶ȵȽ��з������ڸ��ݽ��������ᡢ�Ρ����������ʷ�Ӧ���з�����

 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д�����Ŀ�����������еij���Ԫ�أ�ȱ��ʱ��ͨ��ʳ�ñ���ҩ����������������ij����ҩ��˵����IJ�����Ϣ��ͼ��ʾ���ֽ�100g����ֳ�5�ȷݣ���μӵ���40Ƭ��ҩ���Ƴɵķ�ĩ�У������ɷֲ������ᷴӦ�����õ�������������ͼ2��������й���Ϣ�ش����⣮ 
��1�� | ��3�� | ��4�� | |
���������������g�� | 20 | 20 | 20 |
ʣ������������g�� | 35 | a | 20 |
��1������ȱ���׳��ֵļ����� �� ��ʱ����ҽ��ָ���·��ñ���ҩ���⣬�ճ�������Ҫ��������ʳ�
��2����Ʒ�Ʋ���ҩ����CaCO3������������ �� a����ֵΪ ��
��3��������������ʵ���������Ϊ��д��������̣�����������һλС������