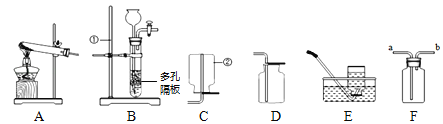
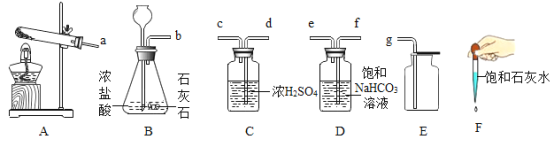
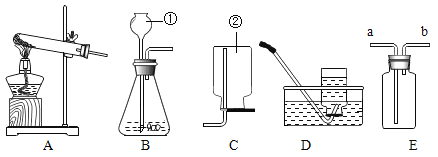
��Ŀ����
����Ŀ�����Ͳ�������Fe�۾��й㷺����;��������ͨFe�۸�����������Ӧ�����Ʊ�������������ͼ��ʾ��
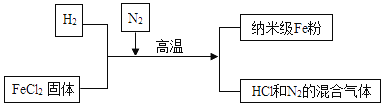
��ش��������⣺
��1������Fe�������������Է�ȼ�����ɺ�ɫ���壬�˺�ɫ����Ļ�ѧʽΪ ��
��2���벹����������Ʊ����յĻ�ѧ����ʽ��H2+FeCl2![]() Fe+ ��
Fe+ ��
��3���о���Ա��������Ƶõ�����Fe����Ʒ�л���������FeCl2���ʡ�
��Ϊ��ȥ��Ʒ�е����ʣ������������£��ȼ� �ܽ⣬Ȼ���� ��ϴ�ӡ���ɣ�
��ȡ��Ʒ20g���������������ᣬ��������0��7g����������Ʒ�е���Fe������������
������������)____ ��
���𰸡���1��Fe3O4 ��2�� 2HCl ��3��ˮ ���� 98%
��������
���⣨1����������������ȼ����������������������Fe�������������Է�ȼ�����ɺ�ɫ���壬�˺�ɫ����Ļ�ѧʽΪ��Fe3O4 ��
��2�����ݻ�ѧ��Ӧǰ���ԭ�ӵ�������������2HCl
��3����������������ˮ����FeCl2����ˮ�����ȼ�ˮ�ܽ⣬Ȼ���ٹ��ˡ�ϴ�ӡ���ɣ�
������20g��Ʒ����������Ϊxg
Fe + 2HCl=FeCl2 + H2��
56 2
x 0��7g
![]()
x=19��6g
��Ʒ��������������=![]() x 100% =98%
x 100% =98%

 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�