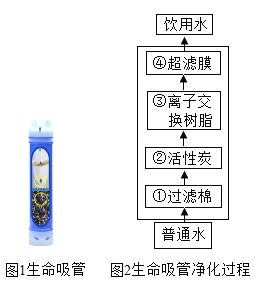
题目内容
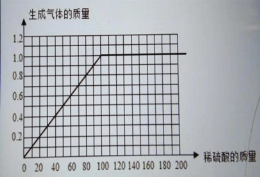
【题目】某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表。
样品 | 第1份 | 第2份 | 第3份 | 第4份 |
取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
试计算:
⑴根据测得的数据分析,第1份样品中 (填物质)完全反应了。
⑵列式计算黄铜屑样品中的锌的质量分数。
⑶请在图中画出在50.0g样品中加稀硫酸的质量与产生气体质量变化关系的示意图。
【答案】(1)稀硫酸
(2)65%
(3) 
【解析】
(1)从表中的数据可以看出,50g合金最多可以和100g稀硫酸反应恰好完全反应,生成1.0g氢气,所以第一、二次稀硫酸反应完了,金属有剩余;第三、四次金属反应完了,稀硫酸有剩余。故填:稀硫酸。
(2)设样品中锌的质量分数为x
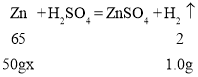
65/50gx=2/1.0g,x=65%
(3)当稀硫酸为40g时,氢气为0.4g;稀硫酸为80g时,氢气为0.8g;以此类推,稀硫酸为100g时,氢气为1.0g;稀硫酸大于100g时氢气仍然是1.0g,描出这几个点后再连接起来就可以了。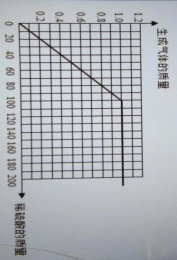

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】制取二氧化碳是初中化学8个基础实验之一。
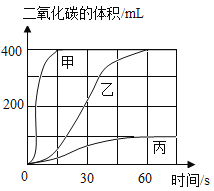
(1)按下表进行实验,取等质量的大理石加入足量的酸中(设杂质不与酸反应),产生的二氧化碳体积随时间的变化曲线如图所示:
实验编号 | 药品 |
I | 块状大理石、10%稀硫酸溶液 |
Ⅱ | 块状大理石、7%稀盐酸溶液 |
Ⅲ | 粉末状大理石、7%稀盐酸溶液 |
①实验Ⅱ对应的曲线是乙,反应的文字表达式为 _______。对照实验室制气体的要求,确定可用实验Ⅱ的药品来制备二氧化碳气体。
②实验I对应的曲线是 _______。
③实验室不选用实验Ⅲ的药品来制备二氧化碳,理由是 _______ 。
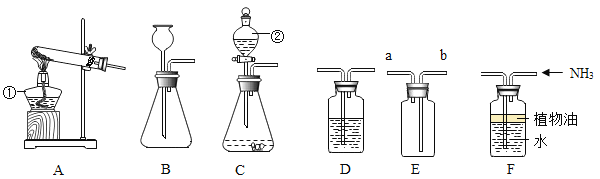
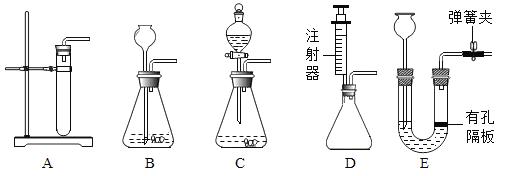
(2)当反应原理确定后,就能以此来选择反应的发生装置了。
①实验室制取气体,通常根据_____和反应条件等因素选择发生装置。
②二氧化碳的发生装置可以选用下图中的装置B、E和________(填字母);装置E相较于装置B,优点是_____ 。
(3)现用氧气传感器分别测定向上排空气法和排水法收集的等体积两瓶CO2气体中氧气的体积分数(数据如图),然后换算出瓶内空气的体积分数(以O2占空气体积的1/5计算),最后推算得到实际收集的气体中CO2的体积分数。下列说法正确的是_______填字母)。
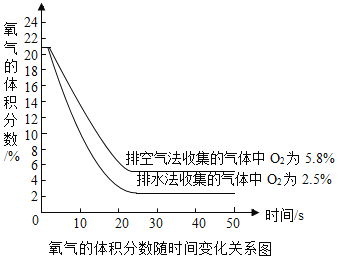
A 向上排空气法收集二氧化碳时,将燃着小木条置于瓶口,当火焰熄灭时,集气瓶中CO2的体积分数为100%
B 上图中用向上排空气法收集的气体中 CO2的体积分数约为94. 2%
C 上图中用排水法收集的气体中 CO2的体积分数约为87.5%
D 相比于向上排空气法,排水法收集的 CO2纯度较高