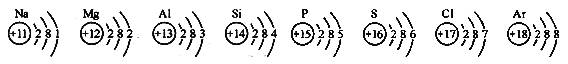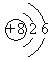题目内容
【题目】制取二氧化碳是初中化学8个基础实验之一。
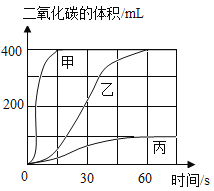
(1)按下表进行实验,取等质量的大理石加入足量的酸中(设杂质不与酸反应),产生的二氧化碳体积随时间的变化曲线如图所示:
实验编号 | 药品 |
I | 块状大理石、10%稀硫酸溶液 |
Ⅱ | 块状大理石、7%稀盐酸溶液 |
Ⅲ | 粉末状大理石、7%稀盐酸溶液 |
①实验Ⅱ对应的曲线是乙,反应的文字表达式为 _______。对照实验室制气体的要求,确定可用实验Ⅱ的药品来制备二氧化碳气体。
②实验I对应的曲线是 _______。
③实验室不选用实验Ⅲ的药品来制备二氧化碳,理由是 _______ 。
(2)当反应原理确定后,就能以此来选择反应的发生装置了。
①实验室制取气体,通常根据_____和反应条件等因素选择发生装置。
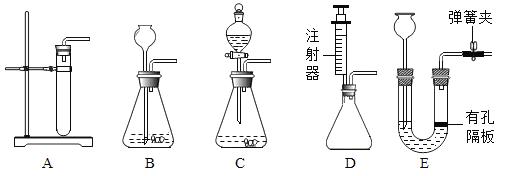
②二氧化碳的发生装置可以选用下图中的装置B、E和________(填字母);装置E相较于装置B,优点是_____ 。
(3)现用氧气传感器分别测定向上排空气法和排水法收集的等体积两瓶CO2气体中氧气的体积分数(数据如图),然后换算出瓶内空气的体积分数(以O2占空气体积的1/5计算),最后推算得到实际收集的气体中CO2的体积分数。下列说法正确的是_______填字母)。
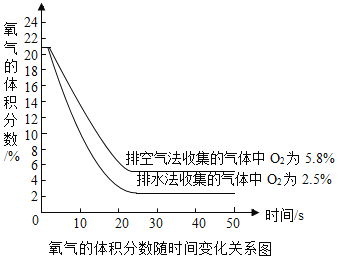
A 向上排空气法收集二氧化碳时,将燃着小木条置于瓶口,当火焰熄灭时,集气瓶中CO2的体积分数为100%
B 上图中用向上排空气法收集的气体中 CO2的体积分数约为94. 2%
C 上图中用排水法收集的气体中 CO2的体积分数约为87.5%
D 相比于向上排空气法,排水法收集的 CO2纯度较高
【答案】碳酸钙+盐酸→氯化钙+二氧化碳+水 丙 反应速率太快,不易控制 反应物的状态 ACD 能控制反应的发生与停止 CD
【解析】
①实验Ⅱ是大理石和稀盐酸反应生成氯化钙、二氧化碳和水,反应的文字表达式为碳酸钙+盐酸→氯化钙+二氧化碳+水;对照实验室制气体的要求,确定可用实验Ⅱ的药品来制备二氧化碳气体。故填:碳酸钙+盐酸→氯化钙+二氧化碳+水。
②实验Ⅱ对应的曲线是乙,实验Ⅲ用的是粉末状大理石,故对应的是曲线甲,则实验I对应的曲线是丙。故填:丙。
③实验室不选用实验Ⅲ的药品来制备二氧化碳,理由是反应速率太快,不易控制。故填:反应速率太快,不易控制。
(2)①实验室制取气体,通常根据反应物的状态和反应条件等因素选择发生装置。故填:反应物的状态。
②实验室用大理石和稀盐酸常温下反应制取二氧化碳,二氧化碳的发生装置可以选用下图中的装置B、E和ACD;装置E相较于装置B,优点是能控制反应的发生与停止。故填:ACD;能控制反应的发生与停止。
(3)A.根据图示可知收集的二氧化碳不可能纯度为100%,所以向上排空气法收集二氧化碳时,将燃着小木条置于瓶口,熄灭。说明二氧化碳的含量高,但不是100%,错误;
B.根据图示可知氧气的含量为5.8%,集气瓶还含有氮气、稀有气体等,所以排空气法收集的气体中二氧化碳体积分数的是小于94.2%,错误;
C.氧气约占空气体积的五分之一,所以排水法收集的气体中CO2体积分数为1-2.5%×5=87.5%,正确;
D.根据图示可知排水法收集的氧气的含量较低,说明排水法收集的二氧化碳气体更纯,正确;
故选:CD。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案【题目】某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表。
样品 | 第1份 | 第2份 | 第3份 | 第4份 |
取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
试计算:
⑴根据测得的数据分析,第1份样品中 (填物质)完全反应了。
⑵列式计算黄铜屑样品中的锌的质量分数。
⑶请在图中画出在50.0g样品中加稀硫酸的质量与产生气体质量变化关系的示意图。