题目内容
【题目】核电荷数为1~18的元素的原子结构示意图等信息如下,请回答下列问题:
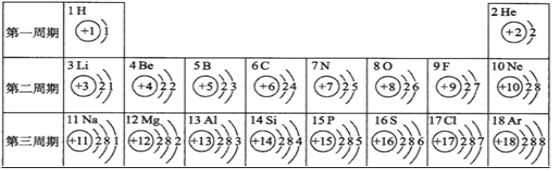
(1)不同种元素最本质的区别是_________。
(2)写出1号元素的单质在17号元素的单质中燃烧的化学方程式___________。
(3)写出8号元素与13号元素所组成物质的化学式并标出铝元素的化合价_________。
(4)在第三周期中,随着原子序数的递增,元素原子核外电子排布的变化规律是__________。
【答案】 质子数(或核电荷数)不同 H2+Cl2点燃 2HCl Al2O3 最外层电子数依次递增
【解析】(1)元素就是具有相同质子数(即核电荷数)的同一类原子的总称,不同种元素最本质的区别是质子数(或核电荷数)不同;(2)写出1号元素的单质即氢气,17号元素的单质为氯气,氢气在氯气中燃烧,生成氯化氢气体,化学方程式:H2+Cl2点燃 2HCl;(3) 氧元素在化合物中显-2价,铝元素在化合物中显+3价,化合物的化学式书写:显正价的元素其符号写在左边,显负价的写在右边,化合价的绝对值交叉约减,得化学式右下角的数字,数字为1时不写,元素化合价的书写:在元素符号的正上方标化合价的数值,正负号在左,数字在右。氧化铝中铝元素显+3价,可表示为:![]() ;(4)在元素周期表中,原子的电子层数等于元素的周期数,第三周期中,随着原子序数的递增,元素原子核外电子排布的变化规律是:从左向右最外层电子数由1到8依次递增。
;(4)在元素周期表中,原子的电子层数等于元素的周期数,第三周期中,随着原子序数的递增,元素原子核外电子排布的变化规律是:从左向右最外层电子数由1到8依次递增。

【题目】根据下表数据回答问题:
温度(℃) | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
NaOH溶解度(g/100g水) | 42 | 51 | 109 | 129 | 174 | 314 | 347 |
A溶解度(g/100g水) | 0.18 | 0.17 | 0.16 | 0.14 | 0.12 | 0.095 | 0.07 |
(1)NaOH的溶解度随温度变化的规律_____________________________________。
(2)在装有100g NaOH固体的小烧杯中,加入100g冰水并充分溶解后测定溶液温度为10℃,此时所得溶液为__________(选填“饱和”或“不饱和”)溶液。再将该烧杯放入盛有热水的大烧杯中,使溶液温度升至60℃,此时溶液中溶质与溶剂的质量比为____________。
(3)利用(2)中所得溶液进行如下实验:

①加入试剂A时发生反应的化学方程式为__________________________________;
②滤液1中含有的溶质是______________;操作Ⅱ的名称是__________________。
【题目】铅蓄电池在生产、生活中使用广泛。其构造示意图如图1,回答下列问题:
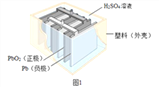
(1)图1铅蓄电池放电过程中,反应的化学方程式为 Pb+PbO2+2H2SO4═2PbSO4+2H2O,据此可知,铅蓄电池在放电时,溶液的pH不断_____(填“增大”、“减小”或“不变”)。
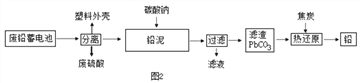
(2)如图2是回收废铅蓄电池的一种工艺流程。
①写出焦炭热还原生成铅的化学方程式: ________________________
②将流程图中的废硫酸和滤液按一定比例混合,再将所得的混合液经____、降温结晶、过滤等操作,可以析出Na2SO4·10H2O晶体。
③如表是一些金属熔点的数据:
金属 | 锡 | 铅 | 铋 | 镉 |
熔点∕℃ | 231.9 | 327.5 | 271.3 | 320.9 |
日常所用保险丝由铋、铅、锡、镉等金属组成,其熔点约为________________。
A. 231.9-327.5℃ B.271.3-320.9℃ C.60-80℃ D.20-40℃
④废硫酸直接排放会污染环境,拟选用如表物质中和后再排放:
物质 | CaCO3 | NH3 | Ca(OH)2 |
市场参考价(元/kg ) | 1.8 | 6.5 | 2.0 |
已知:2NH3+H2SO4═(NH4)2SO4,如果要求花最少的钱来中和等质量、等浓度的废硫酸,则应选择_________ 。