题目内容
【题目】马耳他的国宝“豆腐石头”含有高浓度的氢氧化钙,在马耳他沙滩上开掘一定质量豆腐石,并配制成向澄清的溶液,向其中通入过量的CO2,发生如下反应:Ca(OH)2+CO2=CaCO3↓+H2O;CO2+CaCO3+H2O=Ca(HCO3)2,而Ca(HCO3)2易溶于水。下列四个图示中正确的是( )
A.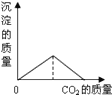 B.
B.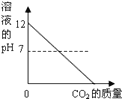
C. D.
D.
【答案】A
【解析】
A、一开始二氧化碳与氢氧化钙反应生成碳酸钙即第一个反应,沉淀质量增加,二氧化碳过量后又发生了第二个反应所以沉淀减少,最后为零,故A正确;
B、由二氧化碳与氢氧化钙反应生成碳酸钙可知溶液碱性减弱,pH值减小,但通过第二个反应可知生成物为碳酸氢钙仍然是显碱性,故pH值不应减小到零。故B错误;
C、由于二氧化碳过量,氢氧化钙的质量最后应该为零,故C错误;
D、由于反应一开始并没有碳酸氢钙生成,所以曲线应该过一段时间才生成碳酸氢钙,故D错误。
故选:A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目