题目内容
【题目】实验室里用64g浓度为12.5%的NaOH溶液和适量CO2气体反应制备纯Na2CO3(已知向NaOH溶液中通入过量CO2气体极易生成 NaHCO3,且无明显现象)。于是卢同学设计了如下实验方法:
①将64 g NaOH溶液等分成两份,分别是放在烧杯A、B中
②向A中通入过量CO2气体
③将A、B两烧杯中的液休混合后蒸干、灼烧。
(1)NaHCO3,属于__(填“酸”、“碱”或“盐”)。
(2)以上方法,步骤②中的方程式为:________:步骤③中的方程式为: NaOH+NaHCO3=Na2CO3+H2O。
(3)若直接向64 g NaOH溶液中通入过量CO2,再将溶液蒸干、灼烧,也能制得与卢同学等质量的纯Na2CO3。与卢同学的方法相比,该方法有何不足:_________。
(4) 卢同学制得了多少质量的纯Na2CO3_______?(请写出计算过程)
【答案】盐 CO2+2NaOH═Na2CO3+H2O,Na2CO3+CO2+H2O═2NaHCO3 既消耗过多能源,如果二氧化碳排放到空气中又会引起温室效应 10.6g
【解析】
(1)根据酸碱盐的定义分析;
(2)通入过量CO2气体最终生成碳酸氢钠;
(3)从能源和环保角度分析;
(4)步骤②中CO2+2NaOH═Na2CO3+H2O,Na2CO3+CO2+H2O═2NaHCO3,步骤③中NaHCO3+NaOH=Na2CO3+H2O,将生产的NaHCO3再倒入等量的NaOH就可以全部转变成Na2CO3分析;
(1)NaHCO3中有钠离子和碳酸氢根离子组成,符合盐的定义,故填:盐;
(2))由题意可知:过量CO2气体通入NaOH溶液中极易生成NaHCO3,化学方程式为:CO2+2NaOH═Na2CO3+H2O以及Na2CO3+CO2+H2O═2NaHCO3,故填:CO2+2NaOH═Na2CO3+H2O,Na2CO3+CO2+H2O═2NaHCO3;
(3)如果向64gNaOH溶液中通入过量CO2,再将溶液蒸干、灼烧,生成的碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,既消耗过多能源,如果二氧化碳排放到空气中又会引起温室效应;故填:既消耗过多能源,如果二氧化碳排放到空气中又会引起温室效应;
(4)m(NaOH)=![]() =8g,步骤②和步骤③消耗的氢氧化钠的质量都是
=8g,步骤②和步骤③消耗的氢氧化钠的质量都是![]() =4g,步骤②中总的反应方程式为:CO2+NaOH═NaHCO3,步骤③中NaHCO3+NaOH=Na2CO3+H2O,设步骤②中生成NaHCO3质量为x,步骤③中生成Na2CO3的质量为y,
=4g,步骤②中总的反应方程式为:CO2+NaOH═NaHCO3,步骤③中NaHCO3+NaOH=Na2CO3+H2O,设步骤②中生成NaHCO3质量为x,步骤③中生成Na2CO3的质量为y,
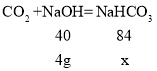
![]() ,x=
,x=![]() =8.4g
=8.4g
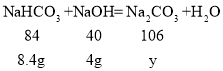
![]() ,y=
,y=![]() =10.6g
=10.6g
答:卢同学制得了纯Na2CO3的质量为10.6g。
故填:10.6g。

【题目】图10是实验室常用的实验仪器与装置,根据所学知识回答下列问题:

(1)请写出有编号的仪器名称:a b
(2)在实验室里,通常用下列方法制氧气:①双氧水和二氧化锰混合;②氯酸钾和二氧化锰混合加热;③加热高锰酸钾;其中最能体现“节能、环保、低碳”理念的制备方法是__ __(填序号),写出该反应的化学方程式: 。
(3)当用A和C装置制取氧气时,发现水槽中的水变成紫红色,为避免此现象发生,应对该实验装置作出的一点改动是 。
(4)为检验CO2气体,可把气体通入F装置中,则F中的试剂是____ ______, F中反应的现象是_______ _______________。
(5)阅读以下资料并回答:
物质 | 制取气体的药品 | 反应条件 | 气体的物理性质 |
氯气 | 二氧化锰固体、 浓盐酸 | 需要加热 | 密度比空气大、 可溶于水 |
制取氯气____________(填“可以”或“不可以”,下同)采用B装置,收集氯气_____ ______采用E装置。