题目内容
【题目】某混合气体可能含有CO、CO2、CH4和HCl中的一种或几种,为了确定其成分,将混合气体按下图所示装置进行实验(假设各步均充分反应或吸收),结果装置A中澄清石灰水不变浑浊,但混合气体的体积明显减小;装置D增重1.8g;装置E增重2.2g。下列关于该混合气体成分的分析中,错误的是
A.一定不含CO2,一定含HCl
B.一定含CH4,一定不含CO
C.一定是CH4和HCl的混合物
D.可能是CO2、HCl、CH4的混合物
【答案】AC
【解析】
装置A中澄清石灰水不变浑浊,但混合气体的体积明显减小,说明混合气体中一定含有氯化氢,可能含有二氧化碳,氯化氢与石灰水反应,导致混合气体中即使含有二氧化碳,也不会使澄清石灰水变浑浊;装置D增加的质量是气体燃烧生成水的质量,装置E增加的质量是气体燃烧生成二氧化碳的质量,只有甲烷燃烧生成水,所以混合气体中一定含有甲烷;设甲烷燃烧生成1.8g水的同时生成二氧化碳的质量为x,则:
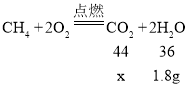
![]()
x=2.2g
装置E增加的质量正好是2.2g,则混合气体中一定不含一氧化碳,否则装置E增加的质量一定大于2.2g。所以混合气体中一定含有甲烷、氯化氢,可能含有二氧化碳,一定不含一氧化碳。故选AC。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案【题目】A B C D表示4种物质,其微观示意图见下表,A和B在一定条件下反应生成C和D。下列说法不正确的是
物质 | A | B | C | D |
|
微观示 意图 |
|
|
|
|
A.B的化学式为SO2
B.生成的C为单质
C.参加反应的A和B分子个数比为2:1
D.16gB参加反应,则生成C的质量为8g
【题目】取20g碳酸钠和碳酸氢钠的固体混合物,加热至不再产生气体2NaHCO3![]() Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
时间 | 0分钟 | 1分钟 | 2分钟 | 3分钟 |
仪器和浓硫酸的质量总和(g) | 150 | 150.9 | 151.8 | 151.8 |
(1)当完全反应后,生成水的质量为_____g。
(2)计算混合物中碳酸氢钠的质量分数________。(要求写出计算过程)
(3)将上述混合物完全分解后的固体溶解于186.2g 水中,待固体完全溶解后所得溶液中溶质的质量分数为_____。
【题目】小金为探究铁制品锈蚀的条件,进行如下实验:
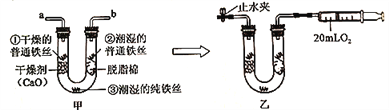
步骤1:利用图甲所示装置,将干燥的O2从导管a通入U形管(装置气密性良好.药品如图所示);待U形管内充满O2后,在导管b处连接一活塞推至底部的注射器,收集20mLO2后在导管a处连接乳胶管并用止水夹夹紧,如图乙所示。
步骤2:一段时间后,观察U形普内的铁丝其现象如表所示。
观察对象 | 现象 |
①干燥的普通铁丝 | 没有明显变化 |
②潮湿的普通铁丝 | 较多红褐色锈斑 |
③潮湿的纯铁丝 | 没有明显变化 |
(1)步骤1中,检查U形管内是否已充满O2的方法是_______。
(2)铁制品锈蚀的条件之一是需要 O2,在此实验中能支持此条件的证据是_____。
(3)通过对比实险现象,此实验还可得出铁制品锈蚀的条件是________。