题目内容
【题目】以硫酸镁与氯化钾为原料制备K2SO4的流程如下。
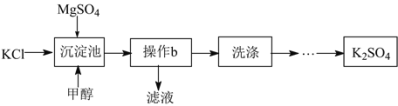
已知:20℃各物质的溶解度如表。
物质 | MgSO4 | MgCl2 | K2SO4 | KCl |
溶解度/g | 33.7 | 54.6 | 11.1 | 34.2 |
(1)沉淀池中相关物质的溶解度如表所示,写出沉淀池中发生的复分解反应的化学方程式_____,反应能在常温下发生的原因是_____。
(2)沉淀池中加入甲醇的目的是_____。
(3)操作b的名称是_____。进行操作b需要的玻璃仪器有烧杯、_____、_____、
(4)检验沉淀是否洗涤完全的试剂是_____。(填序号)
a氢氧化钠溶液 b氯化钠溶液 c稀硫酸
【答案】![]() 20℃时(或常温下),K2SO4的溶解度小 甲醇降低了K2SO4的溶解度 过滤 玻璃棒 漏斗 a
20℃时(或常温下),K2SO4的溶解度小 甲醇降低了K2SO4的溶解度 过滤 玻璃棒 漏斗 a
【解析】
(1)沉淀池中硫酸镁与氯化钾反应生成溶解度更小的硫酸钾和氯化镁,方程式为
![]() ;反应能在常温下发生的原因是20℃时(或常温下),K2SO4的溶解度小;
;反应能在常温下发生的原因是20℃时(或常温下),K2SO4的溶解度小;
(2)沉淀池中加入甲醇的目的是降低K2SO4的溶解度,甲醇易溶于水且不与其他物质反应,硫酸钾溶解度小,故加入甲醇可以降低硫酸钾的溶解度;
(3)操作b的名称是过滤,是将难溶性固体和液体分离的操作,过滤需要用到的玻璃仪器有烧杯、玻璃棒、漏斗;
(4)检验沉淀是否洗涤完全的试剂是氢氧化钠溶液,硫酸镁与氯化钾反应生成硫酸钾和氯化镁,氯化镁与氢氧化钠反应生成氢氧化镁沉淀,所以可以向洗涤剂中加入氢氧化钠溶液,如有沉淀生成,则证明洗涤不完全,反之则洗涤完全。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】某化学兴趣小组的同学在探究金属的有关性质时,进行了如图所示实验:在A实验结束后将两支试管内的物质倒入一洁净烧杯中,一段时间后过滤。为确定过滤后得到的滤渣和滤液的成分,同学们进行了如下实验。

实验一:滤渣的成分是什么?
(1)甲同学取少量滤渣于试管中,加入稀硫酸,无气泡产生,证明滤渣里不含_____。乙同学通过物理方法也得到了同样的结论,请简述方法和现象_____。
实验二:滤液里的溶质有哪些?
(2)同学们认为一定有硫酸亚铁,为确定可能含有的其他溶质,同学们进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取少量滤液,向其中加入少量铁粉 | _____ | 滤液里的溶质还有硫酸和硫酸铜 |
请写出铁与硫酸铜反应的化学方程式:_____。
(3)有同学提出可以直接观察滤液的颜色判断滤液中是否含有硫酸铜,同学们对硫酸铜溶液为什么呈蓝色很感兴趣,决定探究硫酸铜溶液中哪种粒子使溶液呈蓝色。设计的实验方案如下:
实验操作 | 实验现象 | 实验结论 |
①取少量_____溶液,观察颜色 | 溶液呈无色 | 硫酸根离子不能使溶液呈蓝色 |
②取少量硫酸铜溶液,观察颜色 | 溶液呈蓝色 | 铜离子使溶液呈蓝色 |
(4)除了(3)中实验方案外,你还能设计其他方案探究硫酸铜溶液中到底是哪种粒子使溶液呈蓝色吗?实验所需的药品和仪器任选,请简述实验操作和实验现象。
实验搡作 | 实验现象 |
_____ | _____ |
【题目】某化学兴趣小组对“NaOH溶液与盐酸是否恰好完全反应”进行探究,请你参与他们的探究活动,并回答有关问题。
(实验探究)
(1)方案一:甲同学按如图所示的方法先向试管中加入约2mLNaOH溶液,再滴入几滴酚酞溶液,溶液变红。然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为_____色,证明NaOH溶液与稀盐酸恰好完全反应。
![]()
①请指出如图操作中的错误_____。
②写出NaOH溶液与稀盐酸反应的化学方程式_____。
(2)方案二:乙同学按照下面的方案进行实验证明盐酸与氢氧化钠恰好完全反应。
实验步骤 | 实验现象 | 结论 |
取2mLNaOH溶液于试管中,滴入一定量的稀盐酸,再滴加无色酚酞试液,充分振荡 | 没有明显现象 | 二者恰好完全反应,溶液显中性 |
(实验反思)
①方案一在滴入稀盐酸的过程中,若观察到曾有少量气泡出现,请分析产生气泡的原因可能是_____(写出化学方程式)。
②有同学提出方案二不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是_____。为此,还需要选择_____(填一种试剂),再进行实验即可。
(3)某化学兴趣小组为了测定某工厂废水中硫酸的含量,取100g废水于烧杯中,加入80g质量分数为10%的氢氧化钠溶液,恰好完全反应(废水中无不溶物,其它成分不参与反应),请计算:废水中硫酸的质量分数。_____