��Ŀ����
����Ŀ����̨��ӭ������ʱ�����������������ʹ�õ����Ͻ𡢸����Ȳ��ϡ�
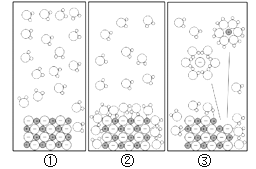
��1���г�������Ҫ�IJ������ںϳɲ��ϵ���_____ ������ĸ��ţ���
A ͭ�������� B ���� C ���� D ����
��2����������ʹ�����Ͻ����Ŀ���ʴ���ܽ�ǿ������Ϊ_____��
��3����ҵ�����ڸ�¯������ԭ����_____���û�ѧ����ʽ��ʾ���������Ĺ���ԭ���辭�����飬��Ŀ����_____��¯���к��й���ƣ� CaSiO3�������й�Ԫ�صĻ��ϼ���_____��
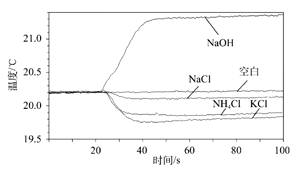
��4��Ϊ̽��ͭ���������Ľ������˳��С��ͬѧѡ��������ҩƷ����ʵ�飬��������֤ͭ���������Ľ������˳�����_____������ĸ��ţ���
A ͭ˿����˿���Ȼ�����Һ
B ��˿��ͭ˿������������Һ
C ��˿����˿��ͭ˿��ϡ����
D ��˿���Ȼ�����Һ���Ȼ�ͭ��Һ
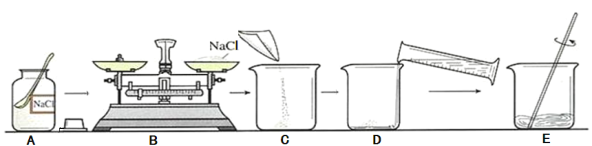
��5��Ϊ�˴ﵽ�վ����Ͻ��ܼ��ŵ�Ŀ�ģ��Ӻ��н�����������ͭ�ķ�ĩ�У��������ȡ����Ҫ����ԭ�Ϻ��йؽ�����ʵ��������£�
[��������]
��2Al+2NaOH+2H2O��2NaAlO2+3H2���� NaAlO2������ˮ��
��2��2NaA1O2+4H2SO4��Na2SO4+Al2��SO4��3+4H2O
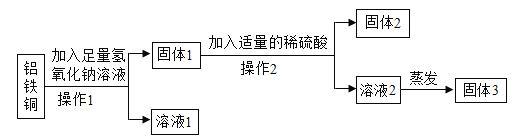
������1��2�Ķ���Ҫ����������ƣ�_____��ϴ�ӣ���ȱ��ϴ�ӣ���Һ2�н��������� Al2��SO4��3��_____���ѧʽ��������������Ҫʹ�ò���������������_____��
����Һ1������֮һ NaAlO2����_____����ᡱ������Ρ������������
�ڶ����������ֽ��������˼���ϡ�����⣬����ѡ�������Լ�_____������ĸ��ţ���
A ����ͭ��Һ B ����������Һ C ϡ����
���𰸡�BC ���������ܵ������ﱡĤ 3CO+Fe2O3![]() 2Fe+3CO2 ����Ӵ�������ӿ췴Ӧ���� +4 BCD ���� Na2SO4 ��ֹ�ֲ����ȣ�����Һ�ηɽ� �� AC
2Fe+3CO2 ����Ӵ�������ӿ췴Ӧ���� +4 BCD ���� Na2SO4 ��ֹ�ֲ����ȣ�����Һ�ηɽ� �� AC
��������
��1���г�������Ҫ�IJ������ںϳɲ��ϵ��ǵ��ڡ����ϣ�
��2����������ʹ�����Ͻ����Ŀ���ʴ���ܽ�ǿ������Ϊ���������ܵ������ﱡĤ��
��3����ҵ�����ڸ�¯������ԭ����������������������һ����̼��Ӧ�������Ͷ�����̼����Ӧ�Ļ�ѧ����ʽ��3CO+Fe2O3![]() 2Fe+3CO2�������Ĺ���ԭ���辭�����飬��Ŀ��������Ӵ�������ӿ췴Ӧ���ʣ�¯���к��й���ƣ� CaSiO3�������и�Ԫ�ػ��ϼ���+2����Ԫ�ػ��ϼ��ǩ�2�����ݻ�������Ԫ�ػ��ϼ۴�����Ϊ���֪����Ԫ�صĻ��ϼ���+4��
2Fe+3CO2�������Ĺ���ԭ���辭�����飬��Ŀ��������Ӵ�������ӿ췴Ӧ���ʣ�¯���к��й���ƣ� CaSiO3�������и�Ԫ�ػ��ϼ���+2����Ԫ�ػ��ϼ��ǩ�2�����ݻ�������Ԫ�ػ��ϼ۴�����Ϊ���֪����Ԫ�صĻ��ϼ���+4��
��4��A��ͭ˿����˿�����ܺ��Ȼ�����Һ��Ӧ��˵��������ã������ж�ͭ�����Ļ����ԣ�
B����˿�ܺ�����������Ӧ��˵�����������ã�ͭ˿���ܺ�����������Һ��˵������ͭ���ã�
C����˿����˿�ܺ�ϡ���ᷴӦ����������ϡ���ᷴӦ�������ݵ����ʱ����죬˵�����������ã�ͭ˿���ܺ�ϡ���ᷴӦ��˵��ͭ����ã������������ã�����ͭ���ã�
D����˿���ܺ��Ȼ�����Һ��Ӧ��˵�����������ã��ܺ��Ȼ�ͭ��Һ��Ӧ��˵������ͭ���ã�
��5���ٲ���1��2�Ķ���Ҫ���ˡ�ϴ�ӣ���ȱ��ϴ�ӣ���Һ2�н��������� Al2��SO4��3��Na2SO4������������Ҫʹ�ò��������������Ƿ�ֹ�ֲ����ȣ�����Һ�ηɽ���
��NaAlO2�����Σ��ڶ����������ֽ��������˼���ϡ�����⣬����ѡ������ͭ��Һ��ϡ���ᣬ������Ϊ���ܺ�����ͭ��Ӧ��������������ͭ��ϡ�����ܺ�����Ӧ�����Ȼ����������������ܺ�ͭ��Ӧ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��������þ���Ȼ���Ϊԭ���Ʊ�K2SO4���������¡�
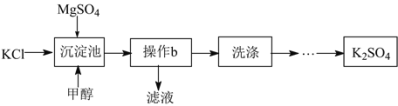
��֪��20������ʵ��ܽ�������
���� | MgSO4 | MgCl2 | K2SO4 | KCl |
�ܽ��/g | 33.7 | 54.6 | 11.1 | 34.2 |
��1����������������ʵ��ܽ�������ʾ��д���������з����ĸ��ֽⷴӦ�Ļ�ѧ����ʽ_____����Ӧ���ڳ����·�����ԭ����_____��
��2���������м���״���Ŀ����_____��
��3������b��������_____�����в���b��Ҫ�IJ����������ձ���_____��_____��
��4����������Ƿ�ϴ����ȫ���Լ���_____��������ţ�
a����������Һ b�Ȼ�����Һ cϡ����