题目内容
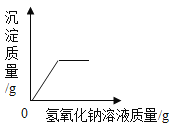
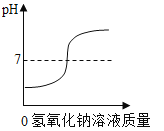
【题目】有A、B、C、D四种元素,其原子结构示意图如图:
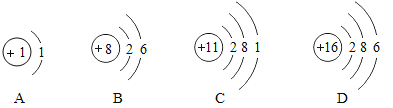
(1)D元素的离子符号为_____。
(2)A、B、D能形成一种化合物,其水溶液的pH_____7(填>、<、=);。
(3)A、B两种元素的原子以1:1的比例形成的化合物为_____。
【答案】S2- < H2O2
【解析】
(1)D元素的原子核内质子数为16,为硫元素;D原子的最外层电子数是6,大于4,在化学反应中易得到2个电子而形成带2个单位负电荷的硫离子,其离子符号为:S2-。
(2)A、B、D三种元素分别是氢元素、氧元素、硫元素,据形成的化合物为硫酸或者亚硫酸,显酸性,其水溶液的pH<7。
(3)A、B元素分别是氢元素、氧元素,A、B两种元素的原子以1:1的比例形成的化合物为过氧化氢,其化学式为H2O2。
故答案为:(1)S2-;(2)<;(3)H2O2 。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】某碳酸钙样品中含有不和盐酸反应的杂质。某同学取12g该样品于烧杯中,再向烧杯中将100g稀盐酸分五次加入样品中,充分反应使气体全部逸出后,称得烧杯中所盛物质的总质量(不包含烧杯自身质量)如下表所示:
实验序号 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
烧杯中所盛物质的总质量/g | 30.90 | 49.80 | m | 87.60 | 107.05 |
请填空:
(1)碳酸钙和盐酸反应的化学方程式为_____;
(2)m的值为_____g;。
(3)12g石灰石样品中碳酸钙的质量分数等于_____;
(4)求反应完全后,溶液中氯化钙的质量_____(写计算过程,保留两位小数)。
【题目】某研究性学习小组在验证“碱使酚酞试液变红”的实验时,发现一个意外现象:将酚酞试液滴入某NaOH溶液中,溶液变成了红色,可是过一会儿红色却消失了。
(提出问题)是什么原因导致滴有酚酞的NaOH溶液由红色褪为无色?
(猜想与假设)他们分别对这种意外现象作如下猜想:
甲同学:可能是酚酞与O2发生了反应;
乙同学:可能是NaOH溶液与空气中的CO2发生了反应;
丙同学:可能与NaOH溶液浓度大小有关;
(设计实验)三位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤 | 设计这一步骤目的 | 实验现象 | 实验结论 |
1.将NaOH溶液加热煮沸 | _____ | 溶液变红,过一会儿红色消失 | 甲同学猜想_____(填“正确”或不正确”) |
2.向冷却后的溶液中滴入酚酞,并滴一些植物油在其上方 | _____ |
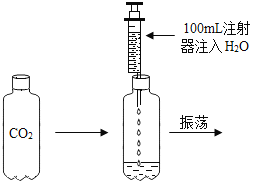
(2)乙同学设计如图装置进行实验,一段时间后,试管中溶液的红色褪去,于是认定自己的猜想正确。

请写出CO2与NaOH溶液反应的化学方程式:_____。甲同学认为乙同学的实验不够严谨,理由是_____。