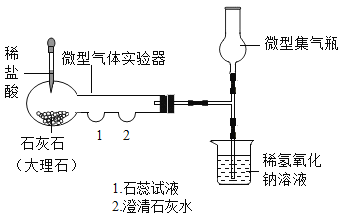
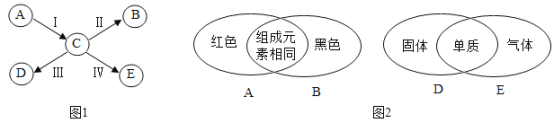
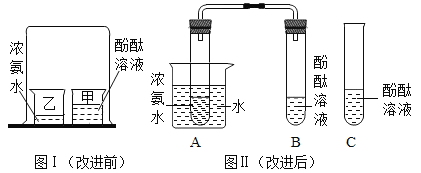
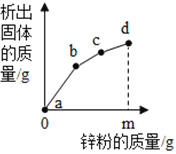
��Ŀ����
����Ŀ��ij̼�����Ʒ�к��в������ᷴӦ�����ʡ�ijͬѧȡ12g����Ʒ���ձ��У������ձ��н�100gϡ�������μ�����Ʒ�У���ַ�Ӧʹ����ȫ���ݳ��Ƶ��ձ�����ʢ���ʵ����������������ձ��������������±���ʾ��
ʵ����� | ��1�� | ��2�� | ��3�� | ��4�� | ��5�� |
����ϡ���������/g | 20 | 20 | 20 | 20 | 20 |
�ձ�����ʢ���ʵ�������/g | 30.90 | 49.80 | m | 87.60 | 107.05 |
����գ�
��1��̼��ƺ����ᷴӦ�Ļ�ѧ����ʽΪ_____��
��2��m��ֵΪ_____g����
��3��12gʯ��ʯ��Ʒ��̼��Ƶ�������������_____��
��4����Ӧ��ȫ����Һ���Ȼ��Ƶ�����_____��д������̣�������λС������
���𰸡�CaCO3+2HCl=CaCl2+H2O+CO2�� 68.7 93.75% 12.49g.
��������
����һ�������ͼ����⣬������Ŀ���������ݣ��ҳ����ɣ�ÿ�μ���20��ϡ������ձ������ӵ�����Ϊ20��-1.1�ˣ������������һ���ɣ���ʯ��ʯ��Ʒ��̼����Ѿ���Ӧ�ꡣ
��1��̼��ƺ����ᷴӦ�Ļ�ѧ����ʽΪCaCO3+2HCl=CaCl2+H2O+CO2����
��2���ɱ������ݿ�֪��ÿ�μ���20��ϡ������ձ������ӵ�����Ϊ20��-1.1�ˣ�m=49.80g+20 g-1.1 g= 68.7 g��
��3���⣺��12gʯ��ʯ��Ʒ��̼��Ƶ�����ΪX��
���������غ㶨�ɿ�֪���ɶ�����̼���������=100g+12g-107.05=4.95g.
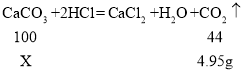
![]()
![]()
12gʯ��ʯ��Ʒ��̼��Ƶ���������![]()
��4���⣺�������Ȼ��Ƶ�����ΪY��
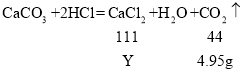
![]()
![]()
�������Ȼ��Ƶ�����Ϊ12.49g.