题目内容
今天化学实验考查内容是“实验室制取氧气及氧气性质的验证”。
实验一:制取氧气
用双氧水、二氧化锰制取氧气的化学反应式为 。
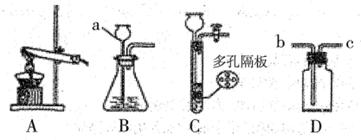
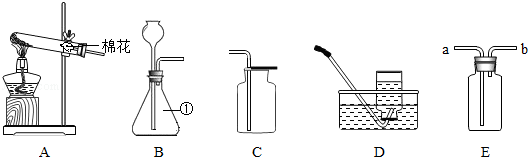
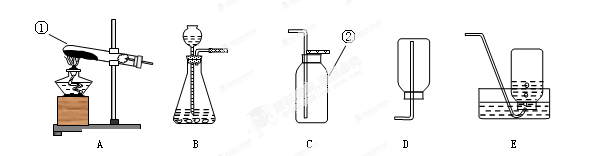
选用的发生装置是 ,(填序号,下同)收集、检验、验满中操作正确的是 。
A B C D E
实验二:验证氧气的性质
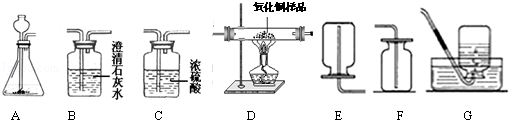
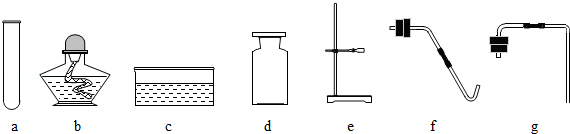
(1)下列实验能证明氧气密度比空气略大的是 (填序号)。B实验还能证明氧气 的性质。
A B C
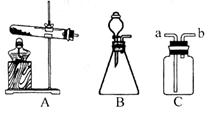
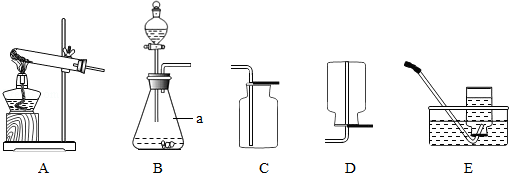
(2)制取氧气并测定其密度(装置如图)
①试管内发生反应的化学反应式???????????,该收集氧气的方法叫 。
②实验中测得的数据有: 加热前试管和固体混合物的总质量(M克),最后量筒内水的体积
(V毫升),为达到实验目的还需测定的数据是 (填序号)。
A.量筒内水的质量(m克)
B.反应完后试管内剩余固体的质量(m克)
C.反应完后试管及管内剩余固体的总质量(m克)
测得氧气的密度为 。
③下列操作一定会使测定结果偏大的是 (填序号)。
A.称量时砝码放在了左盘
B.仰视读量筒读数
C.没将导管从量筒中取出即读数
D.装置未冷却就读数
F.读数时右侧导管内还留有水
实验一H2O2 H2O+O2 B C 实验二 (1)BC 助燃(支持燃烧)
H2O+O2 B C 实验二 (1)BC 助燃(支持燃烧)
(2)①KClO3 KCl+O2排水法 ②C
KCl+O2排水法 ②C  g/mL ③BF
g/mL ③BF
解析试题分析:实验一用双氧水、二氧化锰制取氧气的化学反应式为H2O2 H2O+O2,过氧化氢制取氧气不需要加热,故发生装置选B,收集氧气可以用向上排空气法,且收集装置正确,故选C,检验氧气用带火星的木条,故D错误,验满氧气用带火星的木条放在集气瓶口,故E错误;实验二(1)A说明氧气不易溶于水,故A不符合题意;B甲集气瓶中带火星的木条比乙中带火星的木条燃烧更旺,说明甲集气瓶中氧气浓度比乙大,同时说明氧气的密度比空气大,故选B,C图氧气在下方,空气在上方,说明氧气的密度比空气大,故选C;(2)①试管内发生反应的化学反应式KClO3
H2O+O2,过氧化氢制取氧气不需要加热,故发生装置选B,收集氧气可以用向上排空气法,且收集装置正确,故选C,检验氧气用带火星的木条,故D错误,验满氧气用带火星的木条放在集气瓶口,故E错误;实验二(1)A说明氧气不易溶于水,故A不符合题意;B甲集气瓶中带火星的木条比乙中带火星的木条燃烧更旺,说明甲集气瓶中氧气浓度比乙大,同时说明氧气的密度比空气大,故选B,C图氧气在下方,空气在上方,说明氧气的密度比空气大,故选C;(2)①试管内发生反应的化学反应式KClO3 KCl+O2该收集氧气的方法叫排水法,②为达到实验目的还需测定的数据是反应完后试管内剩余固体的质量(m克)故选C,测得氧气的密度为
KCl+O2该收集氧气的方法叫排水法,②为达到实验目的还需测定的数据是反应完后试管内剩余固体的质量(m克)故选C,测得氧气的密度为 g/mL ,③A.称量时砝码放在了左盘,导致测定结果偏小,B.仰视读量筒读数导致测定结果偏大,C.没将导管从量筒中取出即读数,导致测定结果偏小,D.装置未冷却就读数,导致测定结果偏小,F.读数时右侧导管内还留有水,导致测定结果偏大,故实验操作一定会使测定结果偏大的是BF
g/mL ,③A.称量时砝码放在了左盘,导致测定结果偏小,B.仰视读量筒读数导致测定结果偏大,C.没将导管从量筒中取出即读数,导致测定结果偏小,D.装置未冷却就读数,导致测定结果偏小,F.读数时右侧导管内还留有水,导致测定结果偏大,故实验操作一定会使测定结果偏大的是BF
考点:实验室制取氧气及氧气性质的验证。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案