题目内容
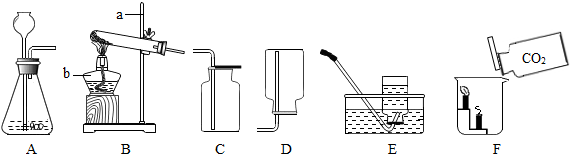
实验室利用下图所示装置进行O2、CO2的制取和有关性质的研究。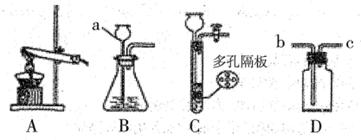
(1)编号仪器a的名称为 ;
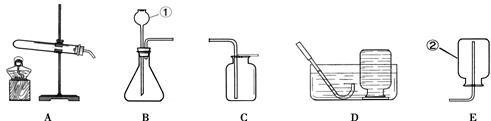
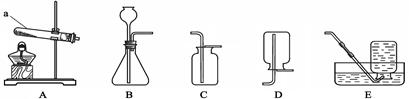
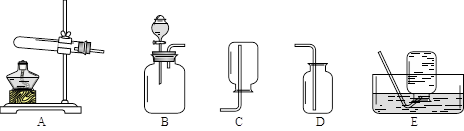
(2)甲同学用氯酸钾和二氧化锰来制取O2,应需用图中的发生装置 (填编号),该反应的化学方程式是 ;
(3)乙同学用大理石和稀盐酸制取CO2,为能随时控制反应的发生和停止,则应选择图中的发生装置 (填编号),若用D装置来收集CO2,则气体应从 (填"b”或“c”)端通入。D装置还能检验气体;检验CO2时,瓶中可放澄清石灰水,发生反应的化学方程式为 ;
(4)实验室要制取0.1 mol CO2,则理论上最少需要含碳酸钙多少g的大理石?(根据方程式列式计算)。
(1)长颈漏斗
(2)A 2KClO3 2KCl+3O2↑
2KCl+3O2↑
(3)C b CO2+Ca(OH)2→CaCO3↓+H2O
(4)10g
解析试题分析:(1)根据仪器的形状和用途书写仪器的名称;(2)根据反应物的状态和反应条件确定发生装置,在氯酸钾的分解反应中,氯酸钾是反应物,二氧化锰是这个反应的催化剂,生成物是氯化钾和氧气,根据以上信息书写化学方程式;(3)图中的C装置能随时控制反应的发生和停止;由于二氧化碳的密度比空气大,要使用D装置收集二氧化碳,应从b端通入;二氧化碳与氢氧化钙反应生成碳酸钙和水,根据以上信息书写化学方程式;(4)要计算碳酸的质量,首先要根据碳酸钙与稀盐酸反应的化学方程式及二氧化碳的物质的量,计算出碳酸钙的物质的量,然后再根据碳酸钙的摩尔质量计算出碳酸钙的质量。
解:设需含碳酸钙x mol的大理石
CaCO3+2HCl→CaCl2+H2O+ CO2↑ (1分) (1分)
(1分)
x =" 0.1" mol (1分)
m(CaCO3) =" 0.l" mol×100 g/mol="10" g (1分)
考点:氧气的制,二氧化碳的制取,化学方程式的书写,根据化学方程式的计算。