题目内容
【题目】小昌同学从家里捡来了一些鸡蛋壳(主要成分为碳酸钙),为测定碳酸钙的含量,他做了如下的实验:首先,称取50g鸡蛋壳样品,然后将150mL盐酸分5次加入(假设杂质均不与盐酸反应,也不溶于水).实验过程中的数据记录如下表:

(1)x=______g
(2)小昌测得鸡蛋壳样品中碳酸钙的质量分数是多少____?
(3)若用80克鸡蛋壳制取二氧化碳,最多能生成多少克____?(保留到0.1)
【答案】30 90% 31.7
【解析】
(1)从分析图表可以发现,每加入30mL稀盐酸,剩余固体的质量就减少10g,所以第二次剩余固体的质量是40g-10g=30g,故填30;
(2)每加入30mL稀盐酸,剩余固体的质量就减少10g,但是第四次加入30mL稀盐酸后,剩余固体的质量只减少5g,说明剩余固体是杂质,碳酸钙的质量=50g-5g=45g,则碳酸钙质量分数=![]() =90%,故填90%;
=90%,故填90%;
(3)鸡蛋壳中碳酸钙质量分数为90%,那么80g鸡蛋壳中含碳酸钙的质量=(80g![]() 90%),然后根据化学方程式计算,设最多能生成二氧化碳质量为X,
90%),然后根据化学方程式计算,设最多能生成二氧化碳质量为X,
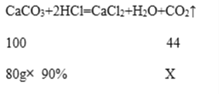
解得X=31.68g,保留到0.1,故填31.7.

练习册系列答案
相关题目
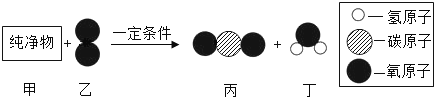
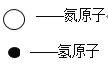
【题目】物质丙是重要的化工产品,在国民经济中占有重要地位。工业上用甲和乙合成丙。甲、乙、丙的微观示意图见下表。
物质 | 甲 | 乙 | 丙 | |
微观示意图 |
|
|
|
(1)甲和乙化学性质不同的原因是___________。
(2)甲、乙、丙中属于化合物的是(填序号)___________。
(3)已知物质丙中氢元素的化合价为+1,则另一种元素的化合价为___________。
(4)现有10 g 的甲和60 g 的乙混合反应制取丙,反应一段时间后,经测定剩余甲的质量为4 g,则剩余乙的质量为___________g。