题目内容
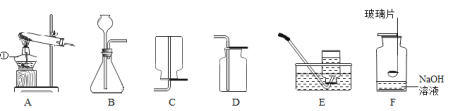
【题目】某同学配制50g 6% 氯化钠溶液,整个操作过程如下图所示,回答下列问题:
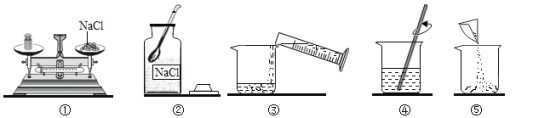
(1)其中操作错误的是_________(填序号)。
(2)图②中盛放氯化钠固体的仪器名称是________。
(3)量水时选用的量筒的量程最合适的是_________(选填字母),读数时视线要与量筒内_________保持水平。
A.10mL B.25mL C.50mL D.100mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 _________(填序号)
A.氯化钠固体不纯 B .用生锈砝码称量 C.装瓶时有少量溶液洒出 D.溶解时烧杯内壁有水珠
【答案】① 广口瓶 C 凹液面的最低处 AD
【解析】
(1)托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了;
(2)图②中盛放氯化钠固体的仪器名称是广口瓶;
(3)溶剂质量=溶液质量-溶质质量,所需溶剂的质量为50g-3g=47g(合47mL),应用规格为50mL的量筒量取水的体积;量筒读数时视线要与凹液面的最低处保持水平;
(4)A、氯化钠固体不纯,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,故选项正确;
B、用生锈砝码称量,会造成实际所取的溶质的质量偏大,则使溶质质量分数偏大,故选项不选;
C、溶液具有均一性,装瓶时有少量溶液洒出,溶质质量分数不变,故选项不选;
D、溶解时烧杯内壁有水珠,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项正确。

【题目】某矿石由MgO、Fe2O3、CuO、SiO2组成,先将矿石粉碎,再用它制备氢氧化镁,流程示意图如图所示:
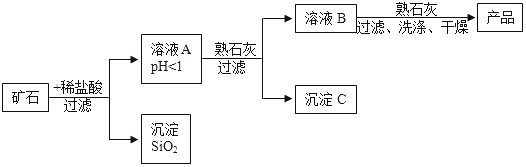
(1)矿石粉碎的目的是___________。
(2)溶液A中共含有________种阳离子。
(3)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为__________,溶液B中一定含有的溶质为_______。