题目内容
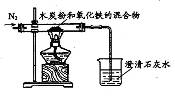
(7分)某同学进行试验探究时,欲配制10%的Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2试剂。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在未溶物。为探究原因,该同学查得Ba(OH)2在20℃时的溶解度2.1 g。
(1)烧杯中未溶物仅为BaCO3,理由是(用化学方程式表示) 。
(2)假设试剂由大量Ba(OH)2和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、氯化铜溶液、烧杯、试管、带塞导气管、滴管
(3)在20℃室温下, (填“能”或“不能”)配制10%的Ba(OH)2溶液。
五、计算与分析题(共2小题,共10分)
目前已制得的纯金属只有90余种,但由这些纯金属按一定组成和质量比制得的合金已达几千种。由于合金更容易适合不同的用途,因此被大量应用于日常生活、工农业及科学研究中。结合所学知识,完成27、28题。
(1)烧杯中未溶物仅为BaCO3,理由是(用化学方程式表示) 。
(2)假设试剂由大量Ba(OH)2和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、氯化铜溶液、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | |
 步骤2:取适量滤液于试管中,滴加稀硫酸。 步骤2:取适量滤液于试管中,滴加稀硫酸。 | 有 ① 生成,说明有Ba2+ |
| 步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中。 | 试管中有 ②生成,烧杯中 ③ ,结合步骤2说明沉淀是BaCO3。 |
| 步骤4:取适量滤液于试管中, ④ 。 | 试管中有蓝色沉淀生成,说明有大量的OH—,综合上面步骤可知试剂由大量Ba(OH)2和少量BaCO3组成,假设成立。 |
五、计算与分析题(共2小题,共10分)
目前已制得的纯金属只有90余种,但由这些纯金属按一定组成和质量比制得的合金已达几千种。由于合金更容易适合不同的用途,因此被大量应用于日常生活、工农业及科学研究中。结合所学知识,完成27、28题。
(1)Ba(OH)2 + CO2 = BaCO3↓+ H2O
(2)①白色沉淀 ②气泡 ③澄清石灰水变浑浊 ④氯化铜溶液
(3)不能
(2)①白色沉淀 ②气泡 ③澄清石灰水变浑浊 ④氯化铜溶液
(3)不能
(1)Ba(OH)2和空气中的二氧化碳生成碳酸钡沉淀,
(2)硫酸根离子和钡离子生成硫酸钡沉淀,碳酸钡和盐酸反应生成气体二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙沉淀,铜离子是蓝色的
(3)20℃Ba(OH)2的溶解度是2.1 g,其溶质质量百分数是2%,故不能
(2)硫酸根离子和钡离子生成硫酸钡沉淀,碳酸钡和盐酸反应生成气体二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙沉淀,铜离子是蓝色的
(3)20℃Ba(OH)2的溶解度是2.1 g,其溶质质量百分数是2%,故不能

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目