题目内容
(6分)小明设计了如下装置,验证CH4可以还原Fe3O4。请回答下列问题:
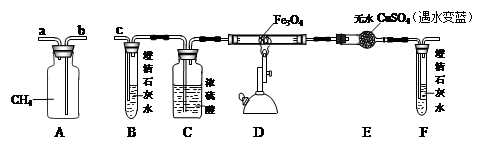
(1)A是储气瓶,向其注水可使CH4流出,使用时应将 (写“a”或“b”)端口与c端口相连。C装置中的作用是 。
(2)实验中,E中药品出现蓝色,F中溶液变浑浊。写出D中玻璃管内反应的化学方程式 。
(3)小明想用B装置证明CH4不能使澄清石灰水变浑浊,进而排除对F装置的干扰。老师分析整个操作过程后指出省略B装置也可达到上述目的,其理由是
。

(1)A是储气瓶,向其注水可使CH4流出,使用时应将 (写“a”或“b”)端口与c端口相连。C装置中的作用是 。
(2)实验中,E中药品出现蓝色,F中溶液变浑浊。写出D中玻璃管内反应的化学方程式 。
(3)小明想用B装置证明CH4不能使澄清石灰水变浑浊,进而排除对F装置的干扰。老师分析整个操作过程后指出省略B装置也可达到上述目的,其理由是
。
(1) a (1分);除去混入CH4中的水蒸气(1分)(答为了排除E装置对H2O检验的干扰也可)
(2)CH4+ Fe3O4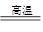 3Fe+CO2+ 2H2O(2分)
3Fe+CO2+ 2H2O(2分)
(3)实验时必须先通甲烷排净装置内的空气后再加热,防止加热爆炸。排空气的过程中甲烷已经与F中的澄清石灰水接触了,甲烷不能使澄清石灰水变浑浊已经得到证明。(2分)
(2)CH4+ Fe3O4
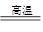 3Fe+CO2+ 2H2O(2分)
3Fe+CO2+ 2H2O(2分)(3)实验时必须先通甲烷排净装置内的空气后再加热,防止加热爆炸。排空气的过程中甲烷已经与F中的澄清石灰水接触了,甲烷不能使澄清石灰水变浑浊已经得到证明。(2分)
(1)由气体密度小于水的密度,故要注水排出CH4气体,应将a端与c端口相连;浓硫酸做干燥剂,故C装置起干燥作用;
(2)实验中,E中药品出现蓝色,说明有水生成;F中溶液变浑浊,说明有二氧化碳气体生成,故化学方程式为CH4+ Fe3O4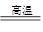 3Fe+CO2+ 2H2O;
3Fe+CO2+ 2H2O;
(3)实验时必须先通甲烷排净装置内的空气后再加热,防止加热爆炸
(2)实验中,E中药品出现蓝色,说明有水生成;F中溶液变浑浊,说明有二氧化碳气体生成,故化学方程式为CH4+ Fe3O4
 3Fe+CO2+ 2H2O;
3Fe+CO2+ 2H2O;(3)实验时必须先通甲烷排净装置内的空气后再加热,防止加热爆炸

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目


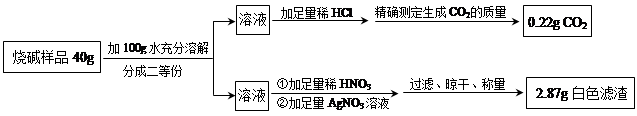
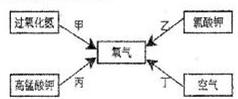
 步骤2:取适量滤液于试管中,滴加稀硫酸。
步骤2:取适量滤液于试管中,滴加稀硫酸。 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑

