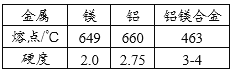
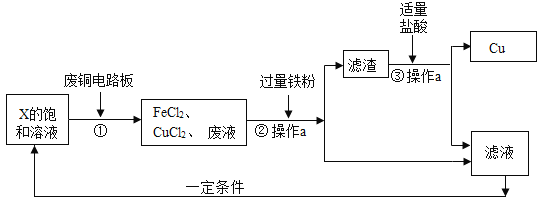
题目内容
【题目】下列问题的研究中,没有利用对比实验思想方法且结论正确的是
A.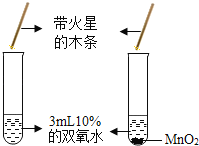 二氧化锰可以增加产生氧气的总量
二氧化锰可以增加产生氧气的总量
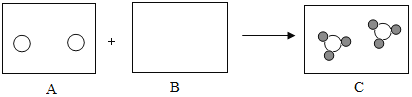
B. 水由氢元素和氧元素组成
水由氢元素和氧元素组成
C.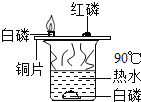 燃烧需要与氧气接触、且温度达到着火点
燃烧需要与氧气接触、且温度达到着火点
D.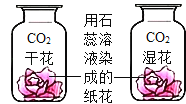 二氧化碳能使石蕊变红
二氧化碳能使石蕊变红
【答案】B
【解析】
A、研究催化剂影响化学反应速度,在双氧水浓度相同的情况下利用有无催化剂的情况下,观察氧气放出速率的快慢,利用了对比实验的原理,但二氧化锰不能增加氧气的产量,故A不符合题意;
B、水通电分解正极生成氧气,负极生成氢气,从而得出水的组成元素,不存在对比实验,故B符合题意;
C、铜片上的白磷与铜片上的红磷属于对照实验,都与氧气接触,都属于可燃物,变量是着火点不同,白磷着火点低,红磷着火点高,热水能达到白磷的着火点,达不到红磷的着火点,从而证明可燃物燃烧温度必须达到可燃物的着火点,属于对比实验,故C不符合题意;
D、纸花都是用石蕊溶液染成,都与二氧化碳接触,变量是一瓶内纸花中有水,一瓶内纸花中没有水,由实验可知没有水的纸花没变色,含有水的纸花变成红色,说明二氧化碳与水反应生成了一种酸,酸使石蕊试纸变成红色,属于对比实验,故D不符合题意。故选B。

【题目】(1)以下是有关CO2气体溶解度的几组数据:
CO2在水中的溶解度(单位:mL)
压强/大气压 | 温度/℃ | ||||
0 | 25 | 50 | 75 | 100 | |
1 | 1.79 | 0.752 | 0.423 | 0.307 | 0.231 |
10 | 15.92 | 7.14 | 4.095 | 2.99 | 2.28 |
25 | 29.30 | 16.20 | 9.71 | 6.82 | 5.73 |
请根据数据外界条件是如何影响气体溶解度的?(答出一条即可);_____。
(2)如图是无结晶水合物的固体甲和乙在水中的溶解度曲线,请根据该曲线图回答下列问题:
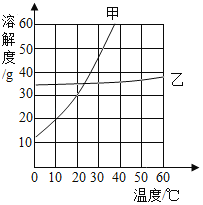
①20℃时,50g 水中溶解_____g甲物质恰好形成饱和溶液。
②现有60℃乙的饱和溶液,与该溶液有关的量有:
A.水的质量 B.溶液中溶质的质量
C.溶液的质量 D.乙的质量分数
E. 60℃时乙的溶解度
保持温度不变,将该饱和溶液稀释,不变的量是_____(填序号)。
【题目】NaHCO3是初中化学教材中重点介绍的一种盐,俗名称_____,NaHCO3溶液呈碱性。某化学兴趣小组要制取一瓶NaHCO3溶液,他们向NaOH溶液中通了一定量的CO2,然后对反应后所得到的溶液进行探究。
(提出问题)反应后溶液中溶质的成分是什么?
(查阅资料)(1)NaHCO3不仅可以与盐酸反应,也可以与NaOH溶液反应。与NaOH溶液反应的化学方程式为:NaHCO3+NaOH=Na2CO3+H2O。
(2)向NaOH溶液中通入少量CO2,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O。继续通入过量CO2,反应的化学方程式为:Na2CO3+H2O+CO2=2NaHCO3。
(猜想与假设)猜想一:含有NaOH和Na2CO3;
猜想二:只含有_____;
猜想三:含有Na2CO3和NaHCO3;
猜想四:只含有NaHCO3。
(设计实验)
实验步骤 | 实验现象 | 解释或结论 |
①取少量样品于试管中,滴加几滴无色酚酞溶液 | 溶液呈红色 | 证明溶液显碱性 |
②另取少量样品于试管中,加入足量的BaCl2溶液,反应完全后,静置过滤 | 加入BaCl2溶液时观察到的现象是_____; | 证明溶液中有Na2CO3 |
③向实验②所得的滤液中滴加稀盐酸 | 有无色无味能使澄清石灰水变浑浊的气体产生 | 证明实验②溶液所得的滤液中有_____。 |
(结论与反思)(1)有同学认为实验①观察到的现象及结论足以证明溶液中有NaOH。你是否同意?请先回答再说出理由_____。
(2)写出实验③中产生气体的化学方程式_____。
(3)通过实验①②③所观察到的现象及结论,最终得出猜想_____是正确的。