题目内容
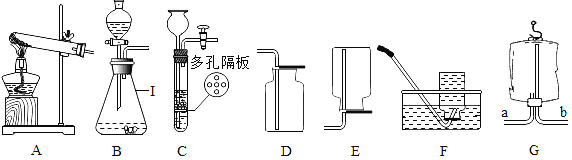
【题目】根据如下实验装置图进行气体制取和性质实验的探究:
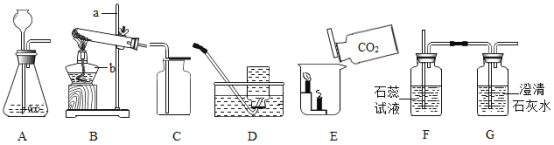
(1)请写出仪器名称:a.____________;b.____________。
(2)实验室里不使用催化剂制取氧气时,可选用的发生装置是________(选填字母);实验室制取CO2气体时发生反应的化学方程式为___________________________;收集CO2一般不选用装置D的原因是_________。同学用图中装置A、F、G组合制备CO2气体并验证相关性质,则装置A应该先连接装置______(选填“F”或“G”);F装置中的现象是____;装置G中的现象是_______________。
(3)如图E所示,向烧杯中慢慢倾倒CO2,发现下层的蜡烛先熄灭,上层蜡烛后熄灭,说明CO2具有的化学性质是_____________________________(答一点即可)。
(4)若装置A中的反应过于剧烈,从安全角度考虑,可以采取的措施有________(选填序号)。
a 用容积较小的锥形瓶 b 将长颈漏斗换成针筒减慢液体的滴加速度
c 加热反应物 d 降低液体反应物的浓度
(5)盐酸中的溶质是氯化氢,实验室常用加热氯化钠固体与浓硫酸的混合物的方法来制取氯化氢气体。在实验室制取氯化氢气体时,________(选填“能”或“不能”)使用装置B作为气体发生装置;发生反应的化学方程式为______________________。
【答案】铁架台 酒精灯 B ![]() 二氧化碳能溶于水 F 石蕊试液变红 澄清石灰水变浑浊 不能燃烧、不支持燃烧 bd 不能
二氧化碳能溶于水 F 石蕊试液变红 澄清石灰水变浑浊 不能燃烧、不支持燃烧 bd 不能 ![]()
【解析】
(1)仪器a的名称是:铁架台;仪器b的名称是:酒精灯;
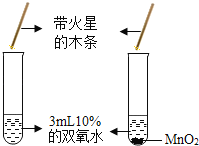
(2)实验室里不使用催化剂制取氧气时,可用加热高锰酸钾制取氧气,该反应属于固体加热反应 ,发生装置应选B;
实验室通常用石灰石和稀盐酸反应制取二氧化碳,石灰石的主要成分是碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为:![]() ;
;
二氧化碳能溶于水,故一般不用排水法收集二氧化碳,故填:二氧化碳能溶于水;
用图中装置A、F、G组合制备CO2气体并验证相关性质,则装置A应该先连接装置F,因为检验气体应“长进短出”,这样才能充分反应;故填:F;
二氧化碳溶于水,且水反应生成碳酸,碳酸显酸性,能使紫色石蕊试液变红,二氧化碳能使澄清石灰水变浑浊,故F装置中的现象是石蕊试液变红;装置G中的现象是:澄清石灰水变浑浊;
(3)向烧杯中慢慢倾倒CO2,发现下层的蜡烛先熄灭,上层蜡烛后熄灭,蜡烛熄灭,说明二氧化碳不燃烧,也不支持燃烧,下层蜡烛先熄灭,说明二氧化碳的密度比空气大,故填:不燃烧,也不支持燃烧;密度比空气大;
(4)a、用容积较小的锥形瓶,不会减缓反应速率,反而会因气体无法及时排除,使装置内压强增大,不符合题意;
b、将长颈漏斗换成针筒减慢液体的滴加速度,可以通过控制药品的滴加速率,从而控制反应速率,减缓反应速率,符合题意;
c、加热反应物,温度升高,会使反应更剧烈,不符合题意;
d、降低液体反应物的浓度,可以减缓反应速率,符合题意。
故选bd;
(5)在实验室制取氯化氢气体时,不能使用装置B作为气体发生装置,因为装置B适用于固体加热反应,该反应是固液加热反应;
实验室常用加热氯化钠固体与浓硫酸的混合物的方法来制取氯化氢气体,该反应属于酸与盐的反应,属于复分解反应,复分解反应为“两种化合物互相交换成分生成另外两种化合物”的反应,故另一生成物为硫酸钠,该反应的化学方程式为:![]() 。
。

【题目】实验一:实验室制备二氧化碳的实验如下.
(1)市售浓盐酸的标签局部如图1,为使制备过程中二氧化碳平稳地产生且较纯净,应将该浓盐酸_____.
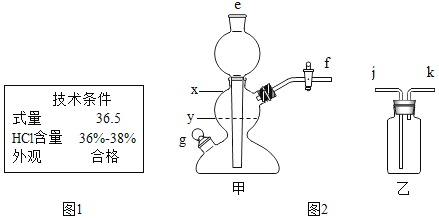
(2)用图2甲装置制备二氧化碳,选择的固体药品是_____(填编号).
a 粉末状石灰石 b 块状大理石
c 粉末状熟石灰 d 块状生石灰
(3)控制所加盐的量,使反应时甲装置内液面位于_____(填“x”或“y”)处为宜.
(4)收集二氧化碳时,应将甲的_____处与乙的_____处连接.(填有关编号)
(5)装置甲也可以用于实验室制取氢气,写出实验室制取氢气的化学方程式_____.
实验二:某小组在学习“二氧化碳与氢氧化钠溶液反应”时,进行了如下探究:
(提出问题)二氧化碳与氢氧化钠反应,还是溶解在水中?
(查阅资料)
①15℃、101KPa时,二氧化碳的溶解度如表:
②15℃时,在酒精中氢氧化钠易溶、碳酸钠微溶.
③通常情况下,稀溶液的体积约等于溶剂的体积.
溶剂 | 1.0L水 | 1.0L酒精 |
溶解度 | 1.0L | 0.5L |
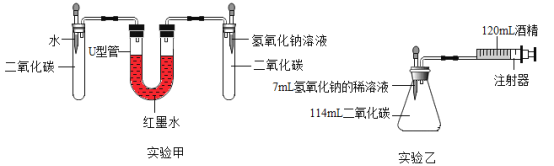
(实验设计)在15℃、101KPa时,制取二氧化碳并用于下图实验甲、实验乙.
(分析与表达)
(1)二氧化碳与氢氧化钠反应的化学方程式是_____.
(2)实验前,两套装置都进行气密性检查,实验甲装置气密性检查的方法是_____.
(3)实验甲中,同时滴入等体积的水和氢氧化钠溶液后的现象是:右侧液面升高,左侧液面下降,一段时间后,右侧液面缓慢下降,左侧上升,最后右侧液面_____(填“高于”或“低于”)左侧
(4)实验乙中,将氢氧化钠完全滴入锥形瓶中,注射器会自动向内移动并将酒精推入锥形瓶,活塞的移动速度是_____.(填答案字母)实验乙中,还可能观察到的现象是__.
A 先慢后快 B 先快后慢
(5)实验乙中,120mL酒精不能换成水,原因是_____.
【题目】KCl和KNO3在不同温度下的溶解度数据如表所示,下列说法中正确的是( )
温度/℃ | 20 | 30 | 40 | |
溶解度/g | KCl | 33 | 38 | 45 |
KNO3 | 31 | 64 | 110 |
A.40℃时,100g水中最多溶解45gKCl
B.随着温度的升高,某饱和KCl溶液中会有固体析出
C.KNO3的溶解度始终大于KCl
D.40℃时,某KNO3溶液中溶质的质量分数一定为 ![]() ×100%
×100%
【题目】有一包白色粉末,可能由CuSO4、Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种组成.为探究其组成,同学们查阅资料得知NaCl、BaCl2溶液呈中性,经过思考设计并进行了以下实验:

请分析实验过程,回答下列问题:
(1)白色粉末中一定不含_____;可能含有_____.
(2)生成白色沉淀的化学方程式为_____.
(3)为最终确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究.
(提出问题)无色滤液中呈碱性的物质是什么?
(作出猜想)
猜想Ⅰ:Na2CO3
猜想Ⅱ:NaOH
猜想Ⅲ:Na2CO3和NaOH
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
①取无色滤液少许于试管中,滴加过量的BaCl2溶液 | 产生白色沉淀 | 猜想Ⅱ不成立 |
②在①反应后的试管中滴加_____ | 溶液变为红色 | 猜想Ⅲ成立 |
(得出结论)白色粉末的成分是_____.
【题目】在一次市级化学研讨课上,化学老师带领学生探究人体吸入的空气和呼出空气的气体成分的差异.
(1)空气的成分按体积计算,大约是:氮气占78%、O2占________、稀有气体占0.94%,CO2占________,其他气体和杂志占0.03%.
(2)(提出问题)呼出的气体中主要含有哪些物质以及它们的含量是多少?
(实验探究)某小组设计了下列实验方案,请你帮助该小组同学完成下列表格.写出实验②反应的化学方程式________;
实验 | 实验操作 | 实验现象 | 结论 |
① | 取两块干燥的玻璃片,向一块干燥的玻璃片上哈气 | 哈气的玻璃片____ 。 | 呼出的气体中含有较多的水蒸气 |
② | 向澄清的石灰水中吹气 | 澄清石灰水变浑浊 | 呼出的气体中含有较多的CO2 |
(3)该小组同学在进行交流时,其他同学对他们的设计提出质疑,认为实验②没有进行对照实验,得出的结论不可靠,提出质疑的理由是________.针对出现的问题,化学老师用CO2传感器测量呼出的气体中CO2的含量(体积分数),曲线如图所示.
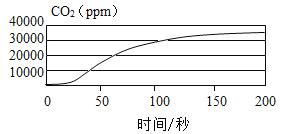
(得出结论)人体呼出的气体中水蒸气、二氧化碳的含量比空气中的________.
(4)请设计实验探究人体吸入的空气和呼出的气体中氧气的含量的差异.
实验操作 | 实验现象 | 结论 |
________ | ________ | ________ |