题目内容
【题目】下图是甲、乙两种固体物质的溶解度曲线。

(1)P点的含义是_____。将乙的饱和溶液从t1℃升温至t2℃,溶液的质量分数_____(填“变大”、“不变”或“变小”)。
(2)t2℃时,将50g甲加入50g水中,充分搅拌,所得溶液的质量为_____g。将甲的饱和溶液变成不饱和的方法之一是__________。
(3)乙的饱和溶液中含有少量甲,可用______________方法提纯乙。
【答案】t1℃时,甲、乙两种固体物质的溶解度相等 不变 90 升高温度或者加水 蒸发溶剂
【解析】
根据甲、乙两种固体物质的溶解度曲线图可知:
(1)P点为甲、乙两种固体物质的溶解度曲线的交点,则P点的含义是t1℃时,甲、乙两种固体物质的溶解度相等。乙的溶解度随着温度的升高而增大,将乙的饱和溶液从t1℃升温至t2℃,乙的饱和溶液变为不饱和溶液,溶质、溶液的质量均不变,则溶液的质量分数不变。
(2)t2℃时,物质甲的溶解度为80g,该温度下100g水中溶解80g甲达到饱和,那么50g水中溶解40g甲溶液达到饱和,因此t2℃时将50g甲加入50g水中,充分搅拌,所得溶液的质量为40g+50g=90g。如图所示甲的溶解度随着温度的升高而增大,将甲的饱和溶液变成不饱和的方法是升高温度或者加水。
(3) 由题意乙的饱和溶液中含有少量甲,蒸发溶剂,乙就会析出晶体,控制好溶剂的量,不要将溶剂完全蒸干,甲就不会析出晶体,过滤就可以得到纯净的乙,因此可用蒸发溶剂方法提纯乙。

【题目】为验证氢氧化钠的化学性质某兴趣小组同学做了如图所示实验。请根据实验回答问题
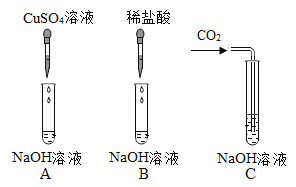
(1)A试管中观察到的实验现象是_____。
(2)甲同学观察到B试管中无明显现象,然后向B试管中继续滴加1~2滴无色酚酞溶液,振荡后溶液仍为无色。此现象_____(填“能”或“不能”)证明氢氧化钠溶液和稀盐酸发生了反应。
(3)为了验证C试管中有碳酸钠生成,乙同学设计的实验方案如表所示,请你帮助填写完整。
(查阅资料)碳酸钠溶液显碱性
方案 | 实验步骤 | 实验现象 | 反应的化学方程式 |
一 | ①取少量反应后溶液于另一支试管中 ②加入过量的稀盐酸 | _____ | _____ |
二 | ①_____ ②_____ | _____ | _____ |
【题目】某同学为了测定石灰石中钙元素的含量(假设石灰石中除CaCO3含钙元素外,杂质不含钙元素、且不溶于水、不与酸反应),进行如下实验:称取20g石灰石样品放入烧杯中,将80g稀盐酸分4等份,分4次加入烧杯中,充分反应后称量。所得数据如下:
次 数 | 1 | 2 | 3 | 4 |
每次加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
充分反应后烧杯中物质的质量/g | 37.8 | 55.6 | 74.5 | 94.5 |
(1)充分反应后共生成CO2的质量为__________g。
(2)求样品中含CaCO3的质量_______(列化学方程计算)。
(3)该石灰石中钙元素的质量分数为____________。
【题目】下表是 20℃时部分物质的溶解度数据。
物质 | Ca(OH)2 | NaOH | CaCO3 | Ca(HCO3)2 | Na2CO3 | NaHCO3 |
溶解度/g | 0.16 | 109 | 0.0065 | 16.6 | 21.8 | 9.6 |
(1)配制溶液:配制 50g11%氢氧化钠溶液的基本步骤是:计算—称取氢氧化钠固体—量取水—溶解—装瓶贴标签。 用托盘天平称取氢氧化钠固体的质量_________ g。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向稀氢氧化钠溶液中通入 CO2,先生成 Na2CO3,继续通入 CO2,Na2CO3 会转化为 NaHCO3,已知后者为化合反应,请写出该化合反应的化学方程式:_________。 若向 20℃时饱和 Na2CO3 溶液中通入过量的 CO2,可观察到的现象是_________。
②结合表格中的有关数据,若以 20℃时,100g 饱和溶液吸收 CO2 的质量最大为依据,则除去 CO 气体中的 CO2 杂质,应选择_________溶液(填化学式),欲检验CO2气体的存在,则应选择_________溶液(填化学式)。
③将 2.2g CO2 通入 47.8g 一定浓度的 NaOH溶液中充分反应后(反应过程中没有CO2 逸出,水也没有蒸发),溶液中的溶质仅有 Na2CO3和 NaHCO3 两种物质(NaHCO3 在水中电离成 Na+和 HCO3-),则此时溶液中碳元素的质量分数为__________,在此反应过程中,你认为钠离子的个数_________发生变化?(填写: 有或者没有)
(3)电导率传感器可辅助探究复分解反应的实质。相同条件下,离子浓度越大,电导率越大,溶液导电性越强。将含有酚酞的 Ba(OH)2 溶液平均分成两份置于两个烧杯中 并插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,滴加过程中,这两份溶液的滴加速率始终相同,测得溶液的电导率变化如图所示。下列说法正确的是__________
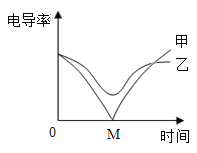
a.乙曲线电导率减小过程中,溶液由红色变为无色
b.乙曲线对应的反应中四种离子数目都减少
c.甲曲线对应氢氧化钡与硫酸钠反应
d.甲曲线上的 M 点代表两种溶液恰好完全反应
【题目】某化学兴趣小组用石灰石和盐酸制取一瓶CO2,验满后,将澄清石灰水倒入集气瓶中,发现没有变浑浊。兴趣小组对这个异常现象进行了探究。
[提出问题]澄清石灰水为什么没有变浑浊?
[查阅资料]
(1) CO2过量时,CaCO3沉淀会转化为可溶于水的Ca (HCO3)2。
(2)AgCl不溶于稀硝酸
[提出猜想] I.石灰水已完全变质;
II.CO2过量;
III.CO2中混有 HCl。
[实验方案]兴趣小组用原药品继续制取CO2,并进行探究。
制备CO2的化学方程式______________。
[实验结论]制取的CO2气体中混入了HCl,所以澄清石灰水没有变浑浊。
[交流讨论]若要收集到纯净、干燥的CO2,需将混合气体依次通入饱和NaHCO3溶液和____________。
步骤 | 实验操作 | 实验现象 | 结论及化学方程式 |
(1) | 取少量澄清石灰水于试管中,加入______溶液。 | 产生白色沉淀。 | 猜想I不成立 |
(2) | 将少量气体通入盛有澄清石灰水的试管中。 | ______________。 | 猜想Ⅱ不成立 |
(3) | 将气体通入盛有_______溶液的试管中,再加稀硝酸。 | _______________。 | 猜想III成立,反应方程式为___________。 |
【题目】如图,A、B、C是气体发生装置,D、E是气体收集装置。请回答问题:

(1)参考示例,利用所学知识完成如表。
气体 | 反应物及反应条件 | 发生装置 | 收集装置及进气口 |
O2 | KMnO4固体,加热 | B | 收集:D,进气口:乙 |
CO2 | 大理石和_____,常温 | _____ | 收集:E,进气口:_____ |
N2 | NH4Cl与NaNO2饱和溶液,加热 | _____ | 收集:D,进气口:_____ |
(2)写出加热KMnO4制取O2的化学方程式_____,现收集到16g O2,则参加反应的KMnO4的质量是_____g。
(3)检查A装置的气密性:连接好装置,从长颈漏斗中加入一定量的热水,使长颈漏斗下端管口浸没在液面以下,迅速关闭活塞,如果观察到_____,说明气密性良好。
