题目内容
【题目】取一定质量的铜和氧化铜的混合物,在空气中充分灼烧,使铜全部转化为氧化铜,消耗氧气8g。向灼烧后的固体中加入稀硫酸至固体恰好完全反应,制得800g质量分数为20%的硫酸铜溶液。
(1)利用化学方程式计算原混合物中铜的质量。
(2)计算原混合物中铜元素的质量分数(计算结果保留至 0.1%)。
【答案】(1)32g (2)88.9%
【解析】
解:(1)氧化铜不与氧气反应,铜与氧气反应生成氧化铜,设原混合物中铜的质量为x。
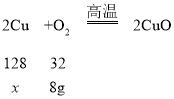
![]() ,解得x=32g,根据质量守恒定律,生成氧化铜的质量为:32g+8g=40g
,解得x=32g,根据质量守恒定律,生成氧化铜的质量为:32g+8g=40g
(2)800g质量分数为20%的硫酸铜溶液中溶质的质量为:800g×20%=160g,设生成160g硫酸铜消耗氧化铜的质量为y。
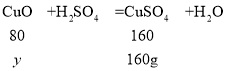
![]() ,解得y=80g
,解得y=80g
则原混合物中氧化铜的质量为:80g-40g=40g,原混合物的质量为:40g+32g=72g
原混合物中铜元素的质量为:40g×![]() +32g=64g,原混合物中铜元素的质量分数分数为:
+32g=64g,原混合物中铜元素的质量分数分数为:![]() =88.9%
=88.9%
答:原混合物中铜的质量为32g,原混合物中铜元素的质量分数为88.9%。

【题目】维C泡腾片是一种常见的补充维生素C的保健品。某品牌维C泡腾片(以下称“本品”)的主要成分如图1所示。

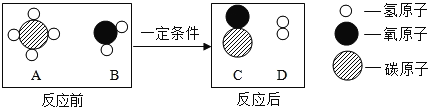
(1)下列关于维生素C的说法正确的是_____(填字母)。
a.维生素C由C、H、O三种元素组成
b.维生素C的相对分子质量为176g
c.维生素C由6个碳原子、8个氢原子和6个氧原子构成
d.维生素C中C、H、O元素的质量比为9:1:12
(2)阅读本品的营养成分表:每100g维C泡腾片含钠5750mg(1mg=10﹣3g)。已知本品其他成分不含钠元素,则本品中碳酸氢钠的质量分数为_____。
(3)维C泡腾片水溶液酸碱性的测定:将本品一片投入蒸馏水中,有气泡产生,反应原理为:H3C6H5O2+3NaHCO3=Na3C6H5O2+3CO2↑+3_____(填化学式)。待不再产生气体后,测得溶液呈酸性。
(4)维C泡腾片中碳酸氢钠质量分数的测定:称量相关实验用品质量,将本品一片投入蒸馏水中,待不再产生气体后,称量锥形瓶及瓶内所有物质的总质量。装置如图2所示。
相关数据如表:
物品 | 反应前 | 反应后 | ||
锥形瓶 | 蒸馏水 | 维C泡腾片 | 锥形瓶及瓶内所有物质 | |
质量/g | 71.75 | 50.00 | 4.00 | 125.53 |
①根据以上数据计算本品中碳酸氢钠的质量分数____________(写出计算过程,结果精确到0.1%)。
②实验测定结果与题(2)计算结果相比有明显偏差,其可能原因是_____。