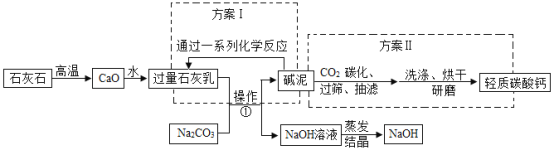
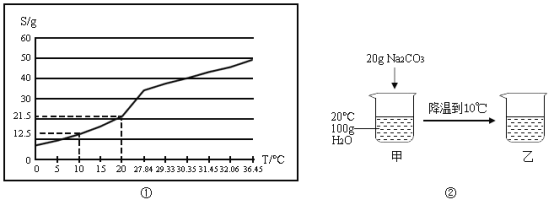
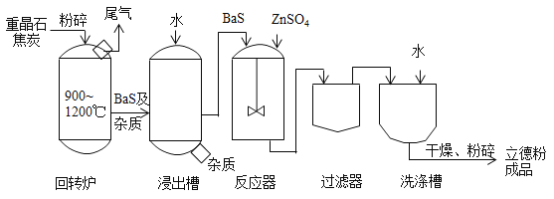
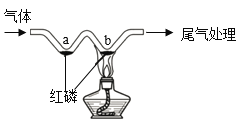
题目内容
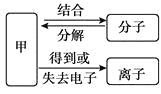
【题目】(FeSO47H2O)古称绛矾,《新修本草》记载“绛矾本来绿色,新出窑未见风者。烧之赤色,故名绛矾矣”。课外小组的同学对其变色产生兴趣,开展如下探究活动。
(查阅资料)
ⅰ.含有Fe3+的盐溶液遇KSCN溶液会变红。
ⅱ.保存FeSO4溶液时要加入稀硫酸和铁钉,置于阴凉处。
(进行实验)
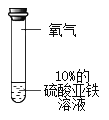
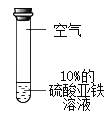
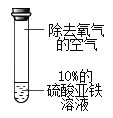
实验1:分别取等量10% FeSO4溶液进行下列三组实验
序号 | ① | ② | ③ |
操作 |
|
|
|
实验现象 | 溶液逐渐变为黄色 | 更长时间后溶液变为黄色 | 溶液颜色不变 |
实验2:分别取等量10% FeSO4溶液进行下列四组实验
编号 | A | B | C | D | |
实验 内容 |
|
|
|
| |
现象 | 30min | 变黄 | 不变色 | 变黄 | 不变色 |
2h | 黄色加深 | 不变色;滴加KSCN溶液,略显红色 | 黄色加深 | 不变色;滴加KSCN溶液,无明显现象 | |
实验3:如图所示,取10%的Fe2(SO4)3溶液20mL于小烧杯中,加入一定量铁粉,搅拌,观察到铁粉减少,溶液变为浅绿色。
回答下列问题:
(1)实验1的探究了__________个问题。其问题之一是_____________
(2)探究2的B实验中,FeSO4溶液变质的反应如下,补全该反应的化学方程式。
4FeSO4+ 2H2SO4+ O2=2Fe2(SO4)3+_______
(3)实验3探究铁钉在抑制硫酸亚铁变质中所起的作用,原理用化学方程式表示为__________。
(4)从实验结果看,单纯向FeSO4溶液中放入铁钉,________(填“能”或“不能”)抑制FeSO4变质。
(5)向硫酸亚铁溶液中加入稀硫酸能抑制其变质,得出此结论的依据是____________。
【答案】两 空气中什么成分使亚硫酸铁溶液变黄(或氧气浓度与亚硫酸铁溶液被氧化快慢的关系) ![]()
![]() 不能 对比实验A、B,加入稀硫酸的亚硫酸铁溶液只有轻微变质
不能 对比实验A、B,加入稀硫酸的亚硫酸铁溶液只有轻微变质
【解析】
(1)实验1探究了两个问题。其问题之一是空气中什么成分使亚硫酸铁溶液变黄(或氧气浓度与亚硫酸铁溶液被氧化快慢的关系)。
(2)根据“4FeSO4 + 2H2SO4+ O2=2Fe2(SO4)3 + ”,由质量守恒定律,尚缺4个氢原子、2个氧原子,故补全该反应的化学方程式为![]() 。
。
(3)实验3探究铁钉在抑制硫酸亚铁变质中所起的作用,原理为硫酸铁与铁反应生成硫酸亚铁,用化学方程式表示为![]() 。
。
(4)根据实验C、D,实验C中,只放入铁钉的FeSO4溶液变质,可知,单纯向FeSO4溶液中放入铁钉,不能抑制FeSO4变质。
(5)根据实验A、B,实验B中加入稀硫酸,亚硫酸铁溶液只有轻微变质,故向硫酸亚铁溶液中加入稀硫酸能抑制其变质,得出此结论的依据是对比实验A、B,加入稀硫酸的亚硫酸铁溶液只有轻微变质。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】教育部从2018年开始,要求在学校普及垃圾分类回收处理的相关知识。某化学活动小组结合所学的知识对此进行一系列实践活动。
I.活动探究:
(1)学会识图分拣垃圾:下列垃圾应投入带有如图图标的垃圾箱内的是______ (填字母序号)。

A 塑料瓶
B 果皮
C 碎瓷片
(2)学会检验有害气体:含氯塑料焚烧时会产生氯化氢等气体。若要检验焚烧后的气体中有氯化氢,可将其通入_____________溶液中,有白色沉淀生成即可。
(3)在农村,人们把秸秆、杂草、人畜粪便等废弃物放在密闭的池中发酵可获得沼气,用作燃料,其中沼气的主要成分是_____________(填写化学式)。
II.实验探究:
[提出问题]如何回收处理废旧电池中的镉?
[查阅资料]
(1)废旧电池中含有镉、汞等元素,这些元素会危害人类健康。
(2)镉(Cd)从溶液中析出时呈海绵状固体。在化合物中通常表现为+2价。
(3)碳酸镉(CdCO3)、氢氧化镉Cd(OH)2都是白色固体、难溶于水。
[设计实验]先将废旧电池进行处理以制得硫酸镉(CdSO4)溶液,用于以下实验。
实验设计 | 实验步骤 | 实验现象 | 实验结论 |
与金属反应 | 取少许溶液于试管中,加入足量的Zn粉,充分反应 | _______ | Zn可以置换出Cd |
与碱反应 | 取少许溶液于试管中,加入足量的氢氧化钠溶液,充分及应 | 产生白色沉淀 | 用化学方程式表示为_______ |
与盐反应 | 取少许溶液于试管中,加入足量的__________溶,充分反应。 | 产生白色沉淀 | 可用该试剂除去CdSO4 |