题目内容
【题目】烧碱是一种重要的化工原料,广泛应用于制取肥皂,以及石油、造纸、纺织和印染等工业。
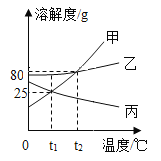
(1)新冠肺炎疫情期间常用的84消毒液的制备离不开烧碱,84消毒液的主要成分是次氯酸钠(NaClO)。烧碱能制备次氯酸钠是因为烧碱能与氯气反应:2NaOH+Cl2=NaClO+X+H2O,其中X的化学式为_____。用途广泛的烧碱还有很多性质,如图表示烧碱与相关物质的关系(箭头表示物质间能转化,实线表示物质间能反应),请回答:
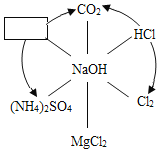
①![]() 中物质的化学式为
中物质的化学式为
②图中物质间发生中和反应的化学方程式为:_____(写出一个即可)。
(2)如图为某化工厂利用苛化法生产烧碱的流程图。“碱泥”曾经是该化工厂最头疼的一种废物,占地堆放对环境造成不利影响。工厂技术人员经过技术革新,变废为宝,使“碱泥”变成了副产品,既解决了占地与环境污染问题,又增加了工厂收入。请分析流程图并回答:
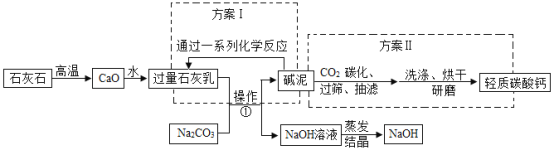
①操作的名称是_____。
②方案Ⅰ的系列反应不涉及的基本反应类型是_____(填序号)。
A化合反应B分解反应C置换反应D复分解反应
③“碱泥”与CO2反应生成碳酸钙的化学方程式为:_____。
④写出图中反应①的化学方程式_____。
【答案】NaCl H2SO4 NaOH+HCl=NaCl+H2O 过滤 C Ca(OH)2+CO2=CaCO3↓+H2O Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
【解析】
![]() 反应前有2个钠原子,2个氧原子,2个氢原子,和2个氯原子,反应后现有1个钠原子,1个氯原子,2个氧原子和2个氢原子,还有有1个氯原子和1个钠原子,组成物质为NaCl;
反应前有2个钠原子,2个氧原子,2个氢原子,和2个氯原子,反应后现有1个钠原子,1个氯原子,2个氧原子和2个氢原子,还有有1个氯原子和1个钠原子,组成物质为NaCl;
![]() 、该物质可以氢氧化钠反应,又能生成二氧化碳,说明显酸性,同时生成硫酸铵,则含有硫酸根,所以为硫酸;化学式为:
、该物质可以氢氧化钠反应,又能生成二氧化碳,说明显酸性,同时生成硫酸铵,则含有硫酸根,所以为硫酸;化学式为:![]() 。
。
![]() 、盐酸与氢氧化钠反应生成氯化钠和水,符合中和反应的特点;反应的化学方程为:
、盐酸与氢氧化钠反应生成氯化钠和水,符合中和反应的特点;反应的化学方程为:![]() ;
;
![]() 、经过操作后实现了固液分离,所以常用的方法为过滤;
、经过操作后实现了固液分离,所以常用的方法为过滤;
![]() 、石灰石分解为分解反应,氧化钙与水反应为化合反应,石灰乳与碳酸钠反应为复分解反应,所以未涉及的反应为置换反应;
、石灰石分解为分解反应,氧化钙与水反应为化合反应,石灰乳与碳酸钠反应为复分解反应,所以未涉及的反应为置换反应;
![]() 、碱泥中含有过滤的氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙和水,反应的化学方程为:
、碱泥中含有过滤的氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙和水,反应的化学方程为:![]() ;
;
![]() 、氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠,反应的化学方程为:
、氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠,反应的化学方程为:![]() 。
。

【题目】(FeSO47H2O)古称绛矾,《新修本草》记载“绛矾本来绿色,新出窑未见风者。烧之赤色,故名绛矾矣”。课外小组的同学对其变色产生兴趣,开展如下探究活动。
(查阅资料)
ⅰ.含有Fe3+的盐溶液遇KSCN溶液会变红。
ⅱ.保存FeSO4溶液时要加入稀硫酸和铁钉,置于阴凉处。
(进行实验)
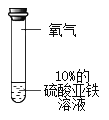
实验1:分别取等量10% FeSO4溶液进行下列三组实验
序号 | ① | ② | ③ |
操作 |
|
|
|
实验现象 | 溶液逐渐变为黄色 | 更长时间后溶液变为黄色 | 溶液颜色不变 |
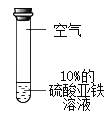
实验2:分别取等量10% FeSO4溶液进行下列四组实验
编号 | A | B | C | D | |
实验 内容 |
|
|
|
| |
现象 | 30min | 变黄 | 不变色 | 变黄 | 不变色 |
2h | 黄色加深 | 不变色;滴加KSCN溶液,略显红色 | 黄色加深 | 不变色;滴加KSCN溶液,无明显现象 | |
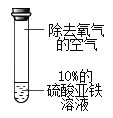
实验3:如图所示,取10%的Fe2(SO4)3溶液20mL于小烧杯中,加入一定量铁粉,搅拌,观察到铁粉减少,溶液变为浅绿色。
回答下列问题:
(1)实验1的探究了__________个问题。其问题之一是_____________
(2)探究2的B实验中,FeSO4溶液变质的反应如下,补全该反应的化学方程式。
4FeSO4+ 2H2SO4+ O2=2Fe2(SO4)3+_______
(3)实验3探究铁钉在抑制硫酸亚铁变质中所起的作用,原理用化学方程式表示为__________。
(4)从实验结果看,单纯向FeSO4溶液中放入铁钉,________(填“能”或“不能”)抑制FeSO4变质。
(5)向硫酸亚铁溶液中加入稀硫酸能抑制其变质,得出此结论的依据是____________。