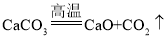题目内容
【题目】一种自加热食品包装中加热包的成分有:生石灰、活性炭、铝粉、铁粉、碳酸钠、氯化钙、硫酸镁。使用时需向加热包加水,课堂上老师分别取适量加热包中的固体样品进行如图实验:
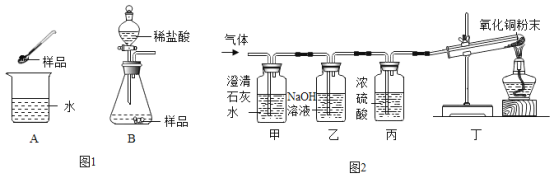
(1)实验A中,将样品加入水里触摸烧杯外壁发烫,其原因是_______。(用化学方程式表示)
(2)实验B中将一定量稀盐酸加入锥形瓶中,剧烈反应生成大量气体,学习小组同学对气体成分和锥形瓶内溶液进行探究。
I、对气体成分进行探究。
(作出假设)假设一:只有H2,假设二:只有CO2,假设三:H2和CO2。
(实验验证)小明同学设计如下实验,对气体成分进行探究。
①当气体通过甲时,澄清石灰水变浑浊,证明假设______不成立。
②丁中出现_______的现象时,证明假设三成立。
③乙的作用是_____。
II、对锥形瓶内的溶液进行探究。
实验后,小萍同学取少量锥形瓶内的溶液于试管中,向其中滴加NaOH溶液,开始一段时间无沉淀生成,其原因是锥形瓶内的溶液中存在______。
(总结反思)通过以上探究,小林同学做了如下的反思归纳:
a.加热包应密封防潮保存
b.向用过的加热包内的固体中加入过量稀盐酸后,过滤可以回收活性炭
c.能与水混合放出热量的物质,均可用作加热包中的发热材料
你认为其中不正确的是_____(填字母)
【答案】CaO+H2O=Ca(OH)2 一 黑色固体变红 吸收CO2 盐酸或HCl c
【解析】
(1)发热主要原理是氧化钙和水反应生成了氢氧化钙,放出大量的热,反应的化学方程式为:CaO+H2O═Ca(OH)2;
(2)①当气体通过甲时,澄清石灰水变浑浊,说明气体中含有二氧化碳,证明假设一不成立;
②氢气有还原性,可将氧化铜还原成铜,丁中氧化铜粉末由黑色固体变红,可知气体中含有氢气,证明假设三成立;
③氢氧化钠和二氧化碳反应生成碳酸钠和水,乙中NaOH溶液的作用是吸收CO2;
Ⅱ、实验后,取少量锥形瓶内的溶液于试管中,向其中滴加NaOH溶液,开始一段时间无沉淀生成,其原因是锥形瓶内的溶液中存在稀盐酸;
[总结反思]通过以上探究,小林同学做了如下的反思归纳:
a.加热包应密封防潮保存,防止吸收空气中的水变质,故正确;
b.氢氧化钙和盐酸反应生成易溶于水的氯化钙和水,向用过的加热包内的固体中,加入过量稀盐酸后,所得是氯化钙和盐酸的混合溶液和活性炭的混合物,过滤,可以回收不溶性固体活性炭,故正确;
c.不是所有能与水混合放出热量的物质均可用作加热包中的发热材料,如浓硫酸具有强腐蚀性,不能用作发热材料,故错误;
故选:c。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案