题目内容
某同学利用以下药品:长、宽和厚度均相同的锌片、铁片与铜片、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,进行锌、铁、铜的金属活动性顺序探究等实验。
(1)实验前,用砂纸打磨金属片的目的是 ;
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合理的方案,如图1所示: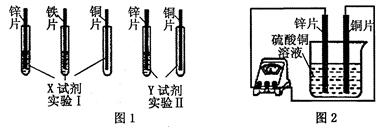
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)实验后,该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,发现溶液呈现青色。他又用混合液分别进行以下实验:
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化为:青色变浅至 色,最终变为无色;
B.向混合液中插入锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜。和老师一起分析粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
②铜和锌构成原电池,电子转移过程中亚铁离子得到电子变成铁单质;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:
①电流表指针是否发生偏转 (选填“是”或“否”);
②铜片表面变粗。
(1)除去金属表面的氧化膜;(2)H2SO4,FeSO4;
(3)浅绿色,Zn+ FeSO4== ZnSO4+Fe;(4)是
解析试题分析:(1)由于锌等金属在空气中易氧化,故打磨的目的是除去金属表面的氧化膜;
(2)判断金属的活动性,可根据金属与酸反应的快慢或金属与盐溶液是否发生置换反应来判断;
(3)锌的活动性比铜和铁强,故能把铜和铁置换出来;
(4)铜和锌构成原电池,活动性强的为负极,由于锌能与硫酸铜反应,故能产生电流。
考点:金属活动性探究

人类的生产生活离不开金属材料。
(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属________的位置移到最后,正好符合由弱到强的____________顺序。
(2)铝、铁、铜是我们生产生活中使用比较广泛的金属。下图用品中,利用金属导热性的是_______,延展性的是___________(填字母序号)。
(3)铜也容易生锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),是铜与空气中的氧气、水和________共同作用的结果。
(4)合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。一般来说,合金的熔点低于任何一种组成金属的熔点。下表是一些金属的熔点数据。
| 金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
| 熔点/℃ | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
①铅锡合金中某种金属的质量分数与合金的熔点有如图所示的关系,其中横坐标表示的是_________的质量分数;当合金熔点最低时,合金中铅与锡的质量比为_________。
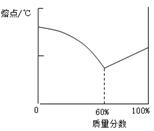
②保险丝由铋、铅、锡、镉组成,其熔点约为__________。
A.15~30℃ B.60~80℃
C.235~250℃ D.300~320℃
化学兴趣小组对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
【设计并实验】用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 20% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式 。
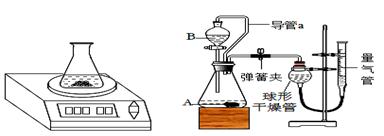
(2)用下图装置收集并测量氢气的体积,其中量筒的作用是 ,氢气应从 (填e或f或g)管通入。
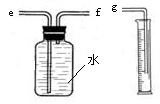
【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是 。
【得出结论】(4)结论是 。
(8分)铁盒罐头过期会出现“胖听”现象(内部产生大量气体,底和盖向外鼓胀),一般分为两类:
(1)化学性“胖听”:一般是铁皮与罐内酸性物质反应产生气体.
(2)生物性“胖听”:一般是罐内物质腐败所致.
用金属针头钉入罐头内,将气体导出进行如下实验,请填写下列实验报告:
| 实验内容 | 实验现象 | 化学方程式 | 属于何种“胖听” |
| (1)点燃导出气体,罩上玻璃杯 | 玻璃杯内壁有 出现 | | |
| (2)导出气体通入澄清的石灰水中 | 石灰水变 | | |