题目内容
化学兴趣小组对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
【设计并实验】用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 20% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式 。
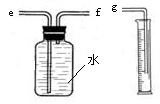
(2)用下图装置收集并测量氢气的体积,其中量筒的作用是 ,氢气应从 (填e或f或g)管通入。
【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是 。
【得出结论】(4)结论是 。
(1)Zn + H2SO4 = ZnSO4 + H2 ↑
(2)根据进入量筒中水的体积,判断生成氢气的体积; f
(3)①③或②④
(4)硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快。
解析试题分析:稀硫酸与锌反应的化学方程式Zn + H2SO4 = ZnSO4 + H2↑,量筒的作用根据进入量筒中水的体积,判断生成氢气的体积,氢气从f进入时正好将瓶中的水排出来,要比较不同质量分数的硫酸对反应快慢的影响,其他因素应该相同,根据控制变量法,应选择①③或②④,以上实验得到的结论是硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快。
考点:金属与酸反应速率的影响因素的探究。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
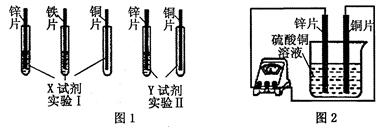
在实验课中,各小组作了如下实验:
| 实验编号 | 1 | 2 | 3 | 4 |
| 实验操作 | 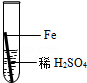 | 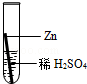 | 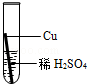 | 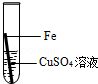 |
实验后,同学们按老师要求将废液都倒在指定的大烧杯中,小科猜想该烧杯中的废液可能有硫酸铜、硫酸锌、硫酸亚铁…,应该可以从中提炼出铁和铜.经思考后,他设计了如图所示的实验,并设法使滤液甲和乙所含的溶质相同.
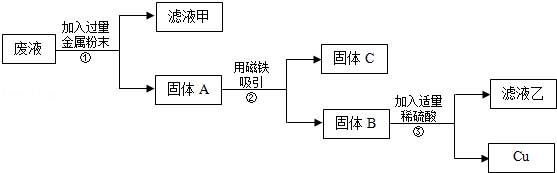
则固体C是 ,操作③的名称是 ,实验中所加的过量金属粉末是 .
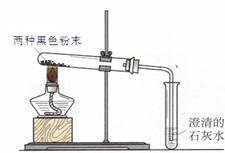
同学们在帮助老师整理实验室时,从1、2号橱窗中发现了两瓶失去标签的黑色粉末药品,并确定了这两瓶黑色粉末是木炭粉、铁粉、氧化铜、高锰酸钾中的两种。他们继续进行了分析、试验和反思:
【查阅资料】 CuO、Fe2O3等金属氧化物与酸反应,生成盐和水
(1)分析:小燕同学认为一定不是高锰酸钾,原因是__________________________________;
(2)实验一:
| 实验操作 | | |
| ①取一种黑色粉末少许,加入到稀硫酸中 | 黑色粉末溶解,溶液颜色变_________ | 此粉末是氧化铜 |
| ②取另一种黑色粉末少许,加入到稀硫酸中 | 黑色粉末不溶解,没看到气体产生 | 此粉末一定不是铁粉 |
(4)实验二:他们又进行了如下实验:将两种黑色粉末混合加热(实验装置如下图),发现黑色粉末逐渐变_______,澄清石灰水变____________。写出两种黑色粉末发生反应的化学方程式__________________。