题目内容
【题目】经过一个月的化学学习,我们认识了许多化学实验仪器,也知道了不少实验操作的要求.
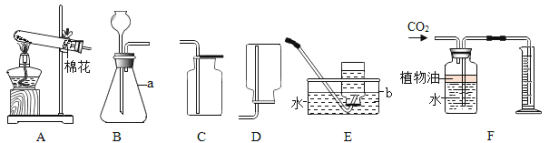
(1)如图中,甲是一个燃着的_____________(填仪器名称),用它来进行加热操作时,应使用火焰的_________焰。

(2)如图中,仪器乙的名称是___________,在量取液体体积时,视线要与仪器内液体的____________保持水平。
(3)某同学欲量取一定量的某液体,将盛有该液体的量筒放平后,俯视量筒的刻度,读数为19 mL;倒出部分液体后,仰视量筒的刻度,读数为11 mL。则该同学实际倒出液体的体积______(填“大于”“小于”或“等于”)8 mL。
【答案】酒精灯 外焰 量筒 凹液面的最底处 小于
【解析】
(1)图中甲是燃着的是酒精灯,我们用它加热物体时要用火焰中温度最高的外焰;
(2)图中乙是能量取一定量液体的量筒,在量取液体体积时,视线要与仪器内液体的凹液面的最低处保持水平,读出的数才准确,如果仰视读数偏小,俯视读数偏大;
(3)俯视液体,看到的读数偏大,但量取的实际体积正好偏小,由俯视液体凹液面最低处,读数为19mL,实际比19mL小;仰视液体,看到的读数偏小,但量取的实际液体偏大,仰视液体凹液面的最低处读数为11mL,实际大于11mL,所以取出液体的体积小于8mL。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】某学习小组对CO2展开研究:

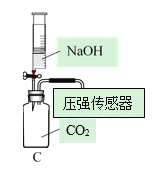
Ⅰ.CO2的制备
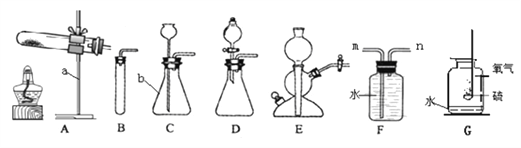
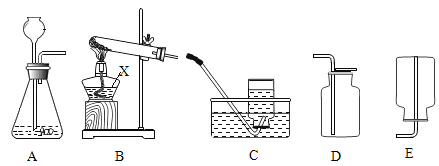
(1)写出图中标号仪器的名称:①______。
(2)实验室制取CO2的反应原理是为______(写化学方程式)。检查A装置的气密性的一种方法是向分液漏斗中加适量水,堵住右侧导气管,打开分液漏斗活塞,若观察到______,则装置不漏气。
(3)实验发现:制取CO2时,最好选用质量分数为7.5%的稀盐酸。现欲配制100g 7.5%的稀盐酸,需要37%(密度为1.18g / mL)的浓盐酸______mL(计算结果精确到小数点后一位),需要水______mL(精确度同上)。量取水时,若仰视读数(其他操作均正确),则所配稀盐酸的质量分数______7.5%(填“>”或“=”或“<”),配制过程不需要的仪器是______。
A.酒精灯 B.量筒 C.烧杯 D.玻璃棒 E.胶头滴管 F.药匙
Ⅱ.CO2的收集
用以下三种方法收集,每种方法均做三次实验,取平均值。将C装置注射器中足量NaOH溶液注入集气瓶中,充分振荡,测集气瓶内气压。(饱和碳酸氢钠溶液可吸收CO2中的HCl气体,NaOH溶液可用来吸收CO2)
方法1:当B装置开始产气泡15s后,用排水法收集 CO2气体,记录集满CO2气体所要的时间为t;
方法2 :当B装置开始产气泡15s后,用向上排空气法收集,收集时间用方法一所用的平均时间t0;
方法3:当B装置开始产气泡15s后,用向上排空气法收集,同时用燃着木条放在集气瓶口,待木条熄灭,立即盖上玻璃片。
实验数据:
方法1 | 方法2 | 方法3 | |
瓶内初始气压(kPa) | 104.2 | 104.2 | 104.2 |
三次实验最终气压平均值(kPa) | 9.3 | 31.8 | 39.7 |
CO2纯度 | 91.1% | 69.5% | X |
数据
(4)三种方法均在15s后开始收集的原因是______。
(5)已知:CO2纯度 =![]() ,则方法3所收集CO2的纯度为______。通过对比,欲收集更高纯度的CO2,应采用______法收集。
,则方法3所收集CO2的纯度为______。通过对比,欲收集更高纯度的CO2,应采用______法收集。
Ⅲ.二氧化碳转化新进展
(6)利用非高热电浆体合成技术可将CO2和甲烷(CH4)反应合成乙酸(CH3COOH),反应的化学方程式为______。
(7)在光催化条件下,CO2和H2反应生成甲烷(CH4)和水,反应的化学方程式为______。
【题目】蔗糖是生活中常见的一种物质。某兴趣小组对“蔗糖的组成”进行探究。
(查阅资料)①蔗糖受热时可以发生分解反应;②铜可以和氧气发生反应生成黑色的氧化铜。
(进行实验)兴趣小组成员进行了下述两种不同的实验方案:
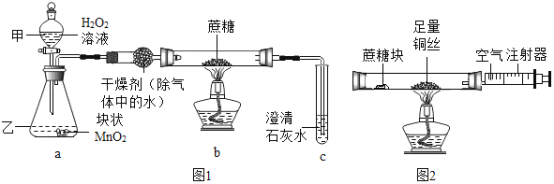
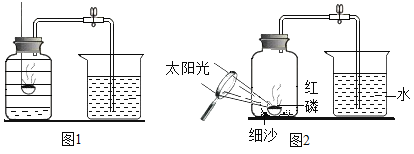
实验一(如图1)
实验步骤 | 实验现象 | 实验结论 |
1.打开甲仪器的活塞 2.待排尽装置中空气后,加热蔗糖 | 玻璃管右端有小液滴产生,C中_______ | 蔗糖在氧气中加热, 生成水和二氧化碳 |
实验二(如图2)
实验步骤 | 实验现象 | 实验结论 |
1.先用酒精灯加热铜丝处,并反复推拉注射器活寨 2.再将酒精灯移置蔗糖处加热 | 铜丝变成黑色_______ | 蔗糖受热分解生成水 |
(解释与结论)
(1)从微粒的角度看,化学变化的实质是_______________;故在化学变化前后,元素种类__________(填“变多”、“变少”或“不变”)。
(2)补全实验一中实验现象:_______;
(3)已知水是由氢、氧元素组成。则二氧化碳是由_______元素组成;依据实验一的结论分析,不能确定蔗糖中一定含有氧元素的原因是_____________;
(4)写出实验二步骤1中反应的符号表达式_________;该反应属于的基本反应类型是____;该步骤中反复推拉注射器活塞的目的是_________;
(5)补全实验二的现象是________________;
(6)综合实验一和实验二的实验探究,分析得出蔗糖是由_______元素组成的。