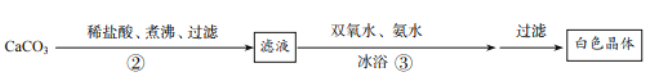
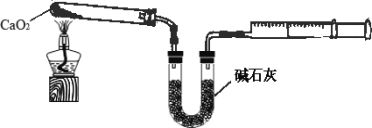
题目内容
【题目】在宏观、微观、符号之间建立联系是化学学科的特点,下图是在点燃条件下,燃料A和足量B反应生成C和D的微观示意图,其中相同的球代表同种原子
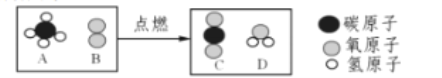

(1)上图所示反应说明,___________ 是保持物质化学性质的最小粒子;
(2)A的相对分子质量是_______________,A中碳、氢元素的质量比为____________;
(3)该反应的化学方程式为 __________________________________________;
(4)在该反应中,生成C和D的质量比为 ______(结果用最简整数比);
(5)若生成物中含有的氧原子总数为n个,则参与反应的B分子数为_________________
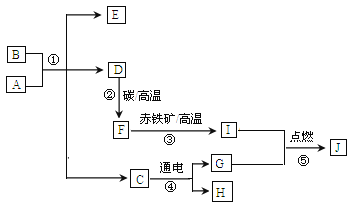
(6)半水煤气的主要成分是H2、CO、CO2、N2和水蒸气,工业上用半水煤气合成氨的过程如图所示。下列说法不正确的是____________
A.半水煤气无色无味 B.反应①是CO与水蒸气发生反应
C.可以用水脱除CO2 D.①和③的反应类型相同
【答案】分子 16 3∶1 CH4+2O2 ![]() CO2+2H2O 11∶9
CO2+2H2O 11∶9 ![]() CD
CD
【解析】
(1)不同物质的分子化学性质不同,上图所示反应说明,分子是保持物质化学性质的最小粒子,故填分子;
(2)由图示可知A的化学式为CH4,相对分子质量是12+4=16,故填16;A中碳、氢元素的质量比=12∶4=3∶1,故填3∶1;
(3)由图可知该反应是甲烷燃烧生成二氧化碳和水的反应,化学方程式故填CH4+2O2 ![]() CO2+2H2O;
CO2+2H2O;
(4)C是二氧化碳,D是水,根据化学方程式CH4+2O2 ![]() CO2+2H2O可知生成C和D的质量比=11∶9,故填11∶9;
CO2+2H2O可知生成C和D的质量比=11∶9,故填11∶9;
(5)根据质量守恒定律,若生成物中含有的氧原子总数为n个,则参与反应的B分子数为![]() ,因为每个B分子中含有2个氧原子,故填
,因为每个B分子中含有2个氧原子,故填![]() ;
;
(6)
A、半水煤气的主要成分是H2、CO、CO2、N2和水蒸气,都是无色无味的气体,故不符合题意;
B、反应①是CO与水蒸气发生反应,生成二氧化碳和氢气,故不符合题意;
C、二氧化碳可溶于水,溶解能力为1:1,水不能大量吸收二氧化碳,二氧化碳和水反应生成的碳酸不稳定,易分解生成二氧化碳和水,导致二氧化碳除不尽,故符合题意;
D、反应①是CO与水蒸气发生反应,生成二氧化碳和氢气,不属于化合反应,反应③属于化合反应,故符合题意;故填CD。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案【题目】据悉宣城高铁将于2020年开通,它将极大方便宣城人出行,也将为宣城发展带来机遇(如图所示)。钢铁和铝合金是建造高铁列车的主要金属材料。

(1)铝化学性质比铁活泼但比铁耐腐蚀,原因是___。在铁中熔入镍铬的目的是___。
(2)用一氧化碳和赤铁矿(主要成分为Fe2O3)炼铁的化学方程式是___。
(3)某生铁和钢的样品中,主要元素的质量分数如下表所示:
Fe | C | S | |
生铁 | 95.94% | 3.52% | 0.06% |
钢 | 98.97% | 0.45% | 0.03% |
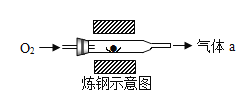
结合数据及炼钢示意图(上图所示)生铁炼钢时通入过量氧气的目的是___,气体a的成分是___。
【题目】我国高铁、航空航天、手机制造等都已经跻身世界一流水平,根据下列材料的应用回答问题。
应用 | “复兴号” 高铁车轮 | “鲲龙”水陆两栖飞机零部件 | 华为折叠手机屏幕 |
用到的材料 | 高速钢 | 钛合金、铝合金 | 聚酰亚胺塑料 |
(1)上述材料中属于有机合成材料的是_________,属于金属材料的是_________(写一种即可)。
(2)飞机外壳用钛合金、铝合金的优点是_________。
(3)在对高铁钢轨中的缝隙进行焊接时,常用铝和氧化铁在高温条件下反应生成熔融状态下的铁和另一种氧化物。该反应的化学方程式为________,反应基本类型是________。