题目内容
【题目】碱式碳酸镁是白色粉末,不溶于水,可用于镁盐制备、制药工业等,其组成一般以xMgCO3yMg(OH)2zH2O 表示。某化学兴趣小组同学在老师带领下参观了碱式碳酸镁的生产流程,并设计实验确定碱式碳酸镁的组成。
Ⅰ 碱式碳酸镁的制备
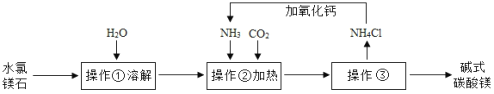
(1)操作③的名称是__________。
(2)上述流程中NH3被循环使用,流程中生成NH3的化学方程式为:①CaO+H2O═Ca(OH)2;②_______。
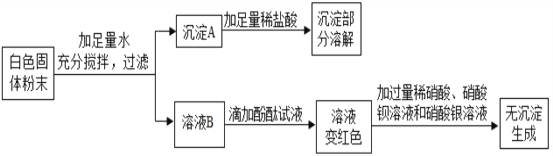
(3)判断碱式碳酸镁是否洗涤干净,可向最后的洗出液中滴加_______(填字母),观察现象判断。
A.盐酸和氯化钡的混合液 B.硝酸和硝酸银的混合液 C.碳酸钠溶液 D.稀盐酸
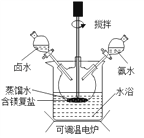
(4)实验室可用复盐 MgCO3 (NH4)2CO3H2O 作原料制备碱式碳酸镁。取一定量原料放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如下图所示),加入一定量蒸馏水,开启搅拌器同时加入预定的氨水,待温度达40℃时滴加卤水并继续滴入氨水,一段时间后通过系列实验操作得到碱式碳酸镁产品。实验中搅拌的目的是_________,水浴加热的优点是 ________ 。
Ⅱ 测定碱式碳酸镁的组成
【查阅资料】
①MgCO3![]() MgO+CO2↑。② Mg(OH)2
MgO+CO2↑。② Mg(OH)2![]() MgO+H2O。
MgO+H2O。
【实验设计】
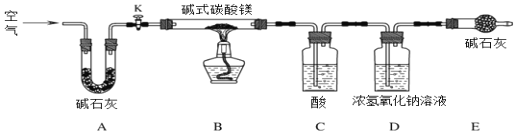
⑸ C中的物质是_________(填名称)。实验过程中,当关闭K后,加热B装置,判断碱式碳酸镁完全分解的方法是:当观察到C中_________,则其已完全分解。D处常用浓氢氧化钠溶液而不用饱和石灰水的原因是____________。
【数据分析】
(6)取碱式碳酸镁[xMgCO3yMg(OH)2zH2O]4.66g,高温煅烧至恒重,得到固体2.00g, CO21.76g,试通过计算确定该碱式碳酸镁中 x:y 的最简整数比________(请写出计算过程)。
(7)若没有 A 装置,则测定得到的z值__________ (填“偏大”、“偏小”、“无影响”)。
【答案】 过滤 ![]() B 反应物充分混合接触,提高反应速率 反应物均匀受热 浓硫酸 无气泡产生 等体积的浓氢氧化钠溶液比饱和石灰水含有更多的溶质,能充分吸收二氧化碳 4∶1 偏大
B 反应物充分混合接触,提高反应速率 反应物均匀受热 浓硫酸 无气泡产生 等体积的浓氢氧化钠溶液比饱和石灰水含有更多的溶质,能充分吸收二氧化碳 4∶1 偏大
【解析】本题考查了物质的相互转化和制备,常见气体的检验与除杂方法,盐的化学性质和化学方程式的书写。
(1)操作③是把液体和固体分离,所以操作③的名称是过滤;
(2)上述流程中,氯化铵和氢氧化钙反应生成氯化钙、水和氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
(3)碱式碳酸镁洗涤干净的标志是最后的洗出液中不含有NH4Cl。判断碱式碳酸镁是否洗涤干净,可向最后的洗出液中滴加硝酸和硝酸银的混合液,如果不产生白色沉淀,说明已经洗涤干净。故选B。
(4)实验中搅拌的目的是使反应物充分混合接触,提高反应速率;水浴加热的优点是反应物受热均匀;
(5)C 中的物质用来吸收水蒸气,所以是浓硫酸;
实验过程中,当关闭 K 后,加热B装置,判断碱式碳酸镁完全分解的方法是:当观察到C中无气泡产生,则其已完全分解;
D处常用浓氢氧化钠溶液 而不用饱和石灰水的原因是等体积的浓氢氧化钠溶液比饱和石灰水含有更多的溶质,能充分吸收二氧化碳。
(6)设碱式碳酸镁中碳酸镁质量为x,生成氧化镁质量为y,
MgCO3![]() MgO+CO2↑
MgO+CO2↑
84 40 44
x y 1.76g
![]() x=3.36g
x=3.36g
![]() y=1.6g
y=1.6g
设碱式碳酸镁中氢氧化镁质量为a,
碱式碳酸镁分解生成氧化镁质量为:2.00g﹣1.6g=0.4g,
Mg(OH)2![]() MgO+H2O,
MgO+H2O,
58 40
a 0.4g
![]() a=0.58g,
a=0.58g,
84x:58y=3.36g:0.58g x:y=4:1,
答:该碱式碳酸镁中 x:y 的最简整数比是4:1。
(7)若没有 A 装置,空气中的水蒸气会进入C装置中,则会导致反应生成的水偏大,从而导致测定得到的z值偏大。

【题目】某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。
I.探究铜锈的组成
【查阅资料】① 铜锈受热易分解 ② 硫酸铜粉末遇水由白色变为蓝色
【进行实验】 小组同学从铜器上取下适量的干燥铜锈,按图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。
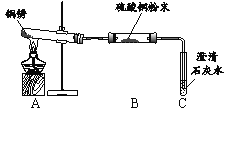
【解释与结论】(1)C中反应的化学方程式是______。
(2)依据以上现象分析,铜锈中一定含有的元素:Cu和______。
II.探究铜生锈的条件
【提出猜想】根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
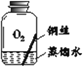
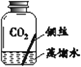
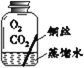
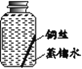
【进行实验】实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面 有绿色物质 | 无明显现象 | 无明显现象 |
【解释与结论】
(3)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是______。
(4)得出“铜生锈一定与CO2有关”的结论,依据的两个实验是______(填编号)。
(5)对比实验②和③,得出的结论是______。
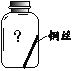
(6)为验证猜想,请在图中将实验⑤补充完整。______
(7)由上述实验可推知,铜生锈的条件是______。
【反思与应用】
(8)结合上述实验,你对保存铜制品的建议是______。