题目内容
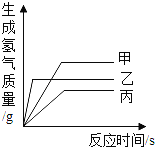
【题目】家庭中长期使用的热水壶底部有一层水垢,主要成分是碳酸钙和氢氧化镁,可用酸溶液来清除水垢。小明同学想通过实验测定水垢中碳酸钙的含量,他将过量的稀盐酸加入到200 g水垢中(假定水垢中杂质不与酸反应),并将产生的CO2气体全部通入到足量的NaOH溶液中(不考虑盐酸的挥发性),NaOH溶液增加的质量与反应时间的关系如图所示,
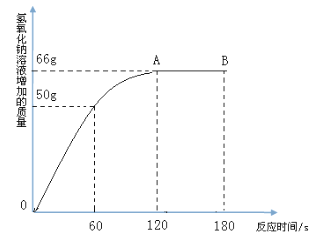
试根据题意回答下列问题:
(1)在滴入稀盐酸的过程中,观察到的一项明显现象是_______________。
(2)计算水垢中碳酸钙的质量分数是___________________(写出相应的计算过程)。
【答案】 冒气泡或固体溶解 75.0%
【解析】水垢主要成分是碳酸钙和氢氧化镁,可用酸溶液来清除水垢。(1)在滴入稀盐酸的过程中,观察到的一项明显现象是冒气泡或固体溶解,碳酸钙与稀盐酸反应生成氯化钙,水和二氧化碳;氢氧化镁与稀盐酸反应生成氯化镁和水。
(2)水垢中碳酸钙的质量分数∶由2NaOH→CO2,CaCO3→CO2,得到2NaOH→CaCO3。
CaCO3→CO2
100 44
x 66g
![]() =
=![]() ,x=150g
,x=150g
水垢中碳酸钙的质量分数∶![]() ×100%=75.0%。
×100%=75.0%。
答∶(1)在滴入稀盐酸的过程中,观察到的一项明显现象是冒气泡或固体溶解。(2)水垢中碳酸钙的质量分数是75.0%。
点睛∶水垢主要成分是碳酸钙和氢氧化镁,可用酸溶液来清除水垢。

练习册系列答案
相关题目