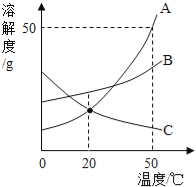
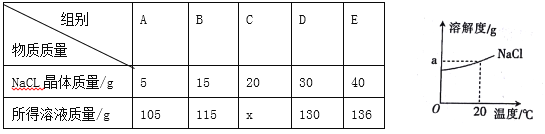
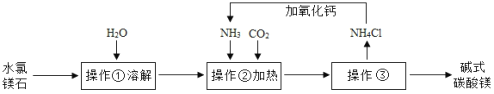
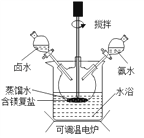
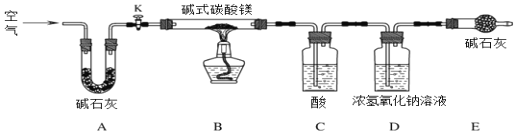
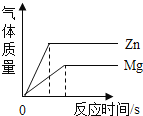
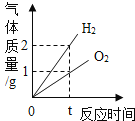
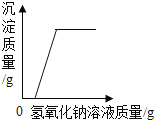
题目内容
【题目】2022年第24届冬季奥运会将在北京市和张家口市联合举行。如图所示,“五环”中相交两环中的物质间能够发生化学反应。
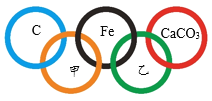
(1)“五环”中已有的3种物质中,属于化合物的是_________。
(2)甲、乙分别是O2、Fe2O3、稀盐酸、Ca(OH)2四种物质中的一种,其中,C与甲反应的现象为_________,物质乙为__________。
(3)“五环”中的物质Fe可以替换成__________(填一种即可)。
【答案】 CaCO3 发出白光、放出大量热 稀盐酸 Mg/Al(或其它合理答案)
【解析】(1)根据CaCO3由钙、碳、氧三种元素组成解答;(2)根据“五环”中相交两环中的物质间能够发生化学反应分析解答;(3)根据铁属于活泼金属分析解答。(1)CaCO3由钙、碳、氧三种元素组成,故属于化合物的是CaCO3;(2)“五环”中相交两环中的物质间能够发生化学反应,甲与碳和铁相交,故甲为O2,因此C与甲反应的现象为发出白光、放出大量热;物质乙与铁和碳酸钙相交,故乙为稀盐酸;(3)铁属于活泼金属,故“五环”中的物质Fe可以替换成镁或铝(Mg或Al)等活泼金属。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目