题目内容
长久使用的热水瓶底部有一层水垢,主要成分是CaCO3,某学校化学研究小组的同学通过实验测定水垢中CaCO3 的含量.取200g水垢,加入足量的稀盐酸300g,充分反应后称量剩余物质质量为434g.试回答下列问题:
(1)产生二氧化碳多少克?
(2)该水垢中CaCO3 的质量分数是多少?
(1)产生二氧化碳多少克?
(2)该水垢中CaCO3 的质量分数是多少?
分析:根据质量守恒定律:反应前后减少的质量就是生成二氧化碳的质量,然后根据二氧化碳的质量 结合碳酸钙和盐酸反应方程式计算出碳酸钙的质量,进而计算出其质量分数.
解答:解:(1)碳酸钙能与盐酸反应生成二氧化碳,反应前后减少的质量就是生成二氧化碳的质量,是:200g+300g-434g=66g;
(2)设生成66g二氧化碳需要碳酸钙的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 66g
=
x=150g
该水垢中CaCO3的质量分数为:
×100%=75%
答:(1)产生二氧化碳66g;
(2)该水垢中CaCO3的质量分数为75%.
(2)设生成66g二氧化碳需要碳酸钙的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 66g
| 100 |
| x |
| 44 |
| 66g |
x=150g
该水垢中CaCO3的质量分数为:
| 150g |
| 200g |
答:(1)产生二氧化碳66g;
(2)该水垢中CaCO3的质量分数为75%.
点评:本题考查了水垢中碳酸钙含量的计算,解答时注意质量守恒定律的应用,并依据反应的化学方程式进行计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
长久使用的热水瓶底部有一层水垢,主要成分是CaCO3和Mg(OH)2,某学校化学研究小组的同学通过实验测定水垢中CaCO3的含量:取200g水垢,加入过量的稀盐酸,同时测量5分钟内生成气体的质量.结果如下表:
试回答下列问题:
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3 (填已或未)反应完全?
(2)当反应完全时,CaCO3消耗的氯化氢为 g.
(3)该水垢中CaCO3的质量分数是多少?
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 质量/g | 30 | 50 | 60 | 66 | 66 |
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3
(2)当反应完全时,CaCO3消耗的氯化氢为
(3)该水垢中CaCO3的质量分数是多少?
长久使用的热水瓶底部有一层水垢,主要成分是碳酸钙,用稀盐酸可以清除水垢.某学校化学课外兴趣小组的同学通过实验测定水垢中碳酸钙的含量,将过量的稀盐酸加到200g水垢中,同时测量4分钟内产生CO2的质量部分结果如下表:[CaCO3+2HCl═CaCl2+H2O+CO2↑]
(1)该小组因故没有记录反应时间为180s时的数
据M.你由表中数据推测,M= g.
(2)反应生成CO2的总质量为 g.(3)根据实验数据,在右边的坐标纸上绘制生成CO2质量与反应时间关系的曲线.你由曲线中推测在反应60s时,生成CO2的质量约为 .
(4)计算水垢中碳酸钙质量分数是多少?
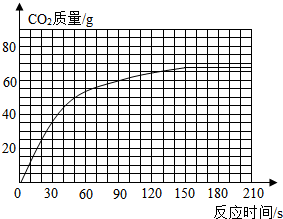
| 时间/s | 30 | 50 | 90 | 150 | 180 | 210 |
| CO2质量/g | 30 | 50 | 60 | 66 | M | 66 |
据M.你由表中数据推测,M=
(2)反应生成CO2的总质量为
(4)计算水垢中碳酸钙质量分数是多少?

长久使用的热水瓶底部有一层水垢,主要成分是CaCO3和Mg(OH)2,某学校化学研究小组的同学通过实验测定水垢中CaCO3的含量:取200g水垢,加入过量的稀盐酸,同时测量5分钟内生成气体的质量,结果如下表:
试回答下列问题:
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3 (填已或未)反应完全?
(2)该水垢中CaCO3的质量分数是多少?
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 质量/g | 30 | 50 | 60 | 66 | 66 |
(1)4分钟后,产生的CO2不再增加,说明水垢中CaCO3
(2)该水垢中CaCO3的质量分数是多少?
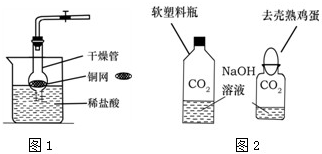 CO2是初中化学重点研究的气体之一.某化学兴趣小组设计了如下实验来探究CO2的制取和性质:
CO2是初中化学重点研究的气体之一.某化学兴趣小组设计了如下实验来探究CO2的制取和性质: