题目内容
称取一定质量的锌粉与质量分数为20%的稀硫酸若干克混合恰好完全反应,生成氢气1.0g。(反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑)计算:
(1)称取锌粉的质量(2)反应后溶液的总质量。
(1)称取锌粉的质量(2)反应后溶液的总质量。
(1)32.5g;(2)276.5g
试题分析:解:设称取锌粉的质量为X,参加反应的稀硫酸的质量为Y 0.5分
Zn + H2SO4 ="=" ZnSO4 + H2↑
65 98 2
X Y×20% 1
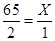
解得 X ="=" 32.5g
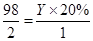
反应后溶液的总质量为
245+32.5-1=276.5g
答:称取锌粉的质量为32.5g,反应后溶液的总质量为276.5g。
点评:这是化学反应联系方程式的计算题,这种题目是每年中考的压轴题,必考题,这类题目的难点在于理顺题目中的已知条件。

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目

 AS。甲、乙、丙三组学生在实验室分别进行该实验,加入的A和硫的质量各不相同,但总质量均为12g。 分别反应时,实验数据记录如下:
AS。甲、乙、丙三组学生在实验室分别进行该实验,加入的A和硫的质量各不相同,但总质量均为12g。 分别反应时,实验数据记录如下: