题目内容
一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如下图所示。
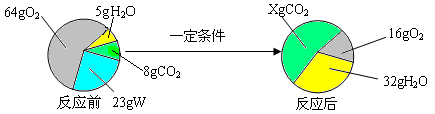
下列关于以上反应的说法中,正确的是

下列关于以上反应的说法中,正确的是
| A.X的值为44 | B.W由碳、氢两种元素组成 |
| C.该反应属于置换反应 | D.W中碳、氢元素质量比为4∶1 |
D
试题分析:根据反应前后各物质的质量变化可知,W反应后没有了,氧气反应后变少了,故此二者为反应物,且W完全反应,氧气反应掉64g-16g=48g;而水和二氧化碳在反应后都变多了,故为生成物,且反应生成水32g-5g=27g。
A、由质量守恒定律可知,反应前物质质量总和=反应后物质质量总和,故64g+5g+8g+23g=32g+16g+Xg,解得X=52g,错误;
B、27g水中含氢元素的质量=27g×
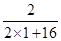 ×100%=3g,结合A可知,反应生成二氧化碳为52g-8g=44g,故其中含碳元素的质量=44g×
×100%=3g,结合A可知,反应生成二氧化碳为52g-8g=44g,故其中含碳元素的质量=44g×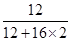 ×100%=12g,结合质量守恒定律中的元素守恒可知,W中的碳、氧元素质量之和=12g+3g=15g,小于已知W的质量23g,由此可知,W中还含有氧元素,错误;
×100%=12g,结合质量守恒定律中的元素守恒可知,W中的碳、氧元素质量之和=12g+3g=15g,小于已知W的质量23g,由此可知,W中还含有氧元素,错误;C、根据题意,该反应可表示为W+O2→CO2+H2O,由于生成物是两种化合物,故不可能为置换反应,错误;
D、结合B可知,W中碳、氢元素质量比=12g:3g=4∶1,正确。故选D
点评:理解和熟记质量守恒定律及其应用,以及与之相关的知识,特别是化学变化中的元素守恒的知识,是解题的关键。

练习册系列答案
相关题目
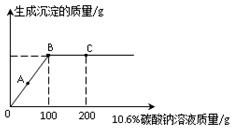
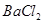 的固体混合物49.3g,加入167g蒸馏水,完全溶解后向该混合溶液中逐滴加入142g的
的固体混合物49.3g,加入167g蒸馏水,完全溶解后向该混合溶液中逐滴加入142g的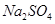 溶液,恰好反应生成
溶液,恰好反应生成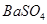 沉淀的质量为23.3g。(提示:BaCl2+Na2SO4=BaSO4↓+2NaCl)。计算恰好完全反应时所得溶液中溶质的质量分数是多少?
沉淀的质量为23.3g。(提示:BaCl2+Na2SO4=BaSO4↓+2NaCl)。计算恰好完全反应时所得溶液中溶质的质量分数是多少?