题目内容
【题目】某研究小组发现,将适量淀粉放入过氧化氢溶液中,过氧化氢溶液的分解速率加快.对于此现象,该小组同学进行了如下探究:
【提出问题】淀粉能否作过氧化氢分解的催化剂?
【作出猜想】淀粉能作过氧化氢分解的催化剂.
【实验验证】
实验编号 | 实验操作 | 实验现象 |
① | 向试管中加入过氧化氢溶液,再将带火星的小木条伸入试管中 | 小木条不复燃 |
② | 向盛有过氧化氢溶液的试管中加入0.5g淀粉,再将带火星的小木条伸入试管中 | 产生大量气泡,小木条复燃 |
③ | 待②中反应结束,将试管中的剩余物质过滤、洗涤、干燥、称量 | 得固体物质0.5g |
④ | 将③中所得固体放入试管中,重新加入过氧化氢溶液,然后将带火星的小木条伸入试管中 | 产生大量气泡,小木条复燃 |
【分析数据、得出结论】
(1)实验③、④证明、淀粉的_____和_____在反应前后均未发生变化,可作过氧化氢分解的催化剂.
(2)写出淀粉催化过氧化氢分解的文字表达式_____.
【实验拓展】
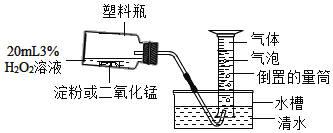
该小组设计了如图所示装置对比淀粉与二氧化锰的催化效果,实验均以生成25mL气体为准,其他可能的影响因素忽略不计,相关数据见下表:
实验编号 | 3%过氧化氢溶液的体积 | 其他物质质量 | 待测数据 |
Ⅰ | 20mL | 淀粉0.5g | a |
Ⅱ | 20mL | 二氧化锰0.5g | b |
(1)上述实验中“待测数据”是指_____;最后结果表明二氧化锰的催化效果较好,则a_____b(填“<”、“>”或“=”).
(2)小明用坩埚钳夹取少量光亮的铜丝,放在酒精灯火焰上灼烧至表面变黑后,迅速插入一只装有20mL3%过氧化氢溶液的试管中,观察到试管内迅速产生大量气泡,且变黑的铜丝的质量和化学性质不发生改变,于是得出结论:氧化铜可以加快过氧化氢分解.有同学认为这个结论不可靠,原因是过氧化氢分解速率加快还可能与_____有关.请你设计实验方案证明_____.
【答案】 质量 化学性质 过氧化氢![]() 水+氧气 生成25mL气体需要的时间 > 温度 分别取温度分别为40℃、90℃的12g、30%的过氧化氢溶液,加热相同质量的二氧化锰,然后记录完全反应所需要的时间
水+氧气 生成25mL气体需要的时间 > 温度 分别取温度分别为40℃、90℃的12g、30%的过氧化氢溶液,加热相同质量的二氧化锰,然后记录完全反应所需要的时间
【解析】【分析数据、得出结论】(1能改变其他物质的反应速率,而本身的质量和化学性质在反应前后不变的物质叫催化剂。)实验③、④证明、淀粉的质量和化学性质在反应前后均未发生变化,符合催化剂的特点,可作过氧化氢分解的催化剂;(2)淀粉催化过氧化氢分解的文字表达式:过氧化氢![]() 水+氧气;【实验拓展】(1)上述实验中“待测数据”是指生成25mL气体所需要的时间;最后结果表明二氧化锰的催化效果较好,则a<b。(2)在酒精灯火焰上灼烧至表面变黑后的铜丝温度高,迅速插入一只装有20mL3%过氧化氢溶液的试管中,观察到试管内迅速产生大量气泡,可能是由于温度升到加快了过氧化氢的分解速度,原因化学反应速度与温度有关;设计实验方案如下:分别取温度分别为40℃、90℃的12g、 30%的过氧化氢溶液,加热相同质量的二氧化锰,然后记录完全反应所需要的时间。
水+氧气;【实验拓展】(1)上述实验中“待测数据”是指生成25mL气体所需要的时间;最后结果表明二氧化锰的催化效果较好,则a<b。(2)在酒精灯火焰上灼烧至表面变黑后的铜丝温度高,迅速插入一只装有20mL3%过氧化氢溶液的试管中,观察到试管内迅速产生大量气泡,可能是由于温度升到加快了过氧化氢的分解速度,原因化学反应速度与温度有关;设计实验方案如下:分别取温度分别为40℃、90℃的12g、 30%的过氧化氢溶液,加热相同质量的二氧化锰,然后记录完全反应所需要的时间。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】如图是测定空气中氧气含量的两套实验装置,请据图回答下列问题(提示:铜粉在加热条件下会与氧气反应生成黑色氧化铜固体):
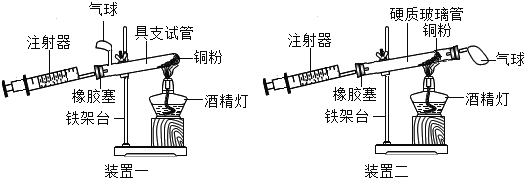
(1)装置一和装置二中气球的位置不同,_____(填“装置一”或“装置二”)更合理,理由是_____.
(2)根据实验测得的相关数据(见下表),计算空气中氧气的体积分数.
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
25mL | 15mL | 7mL | _____ |