��Ŀ����
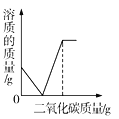
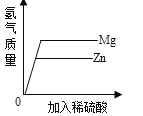
����Ŀ��BaCl2��һ���ؽ�����,��ˮ��Һ���к�ǿ�Ķ��ԡ��������BaCl2��Һ����������MgSO4��Һ�ⶾ��Ϊ�ⶨijBaCl2��Һ��������������,��ȡ100��BaCl2��Һ,���ϼ���MgSO4��Һ,��Ӧ��������Һ�����������MgSO4��Һ��������ϵ��ͼ��ʾ,������100��MgSO4��Һʱ,ǡ����ȫ��Ӧ����֪BaCl2+MgSO4=BaSO4��+MgCl2��ش�

(1)M��ʱ��Һ�е�������___.(������);
(2)��Ӧ���ɳ���������Ϊ_____g
(3)��ԭBaCl2��Һ��������������____(д���������)��
���𰸡��Ȼ�þ 23.3 20.8%
��������
��1��M��ʱ����þ���Ȼ���ǡ����ȫ��Ӧ�������ᱵ�������Ȼ�þ���ʷ�Ӧ����Һ�е��������Ȼ�þ��
��2���μӷ�Ӧ������þ���Ȼ�����������Ϊ��200g����Ӧ����Һ����������Ϊ176.7g�����������ᱵ����������Ϊ:200g-176.7g=23.3g��
��3��������23.5g�����ᱵ��Ҫ�Ȼ���������Ϊx

![]() ��x=20.8g
��x=20.8g
�Ȼ�����Һ�����ʵ���������Ϊ��![]() =20.8%
=20.8%

����Ŀ����A��B����ѡһ�������������𣬰�A�Ʒ֡�
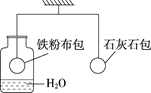
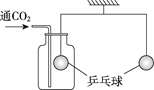
������ͼ��ʾ��װ�����ʵ�飨�ܸ��Ѿ�����ƽ�⣩��
A | B |
���ýϳ�һ��ʱ���������۲���______�����������������½�����������Ϊ������________�����˷�Ӧ�� | ͨ�������̼һ��ʱ�䣬���ƹ����____�����������������½�������������ƿ�е�������NaOH��Һ���ܸ�������ƽ�⣬������Ӧ�Ļ�ѧ����ʽΪ________�� |
|
|
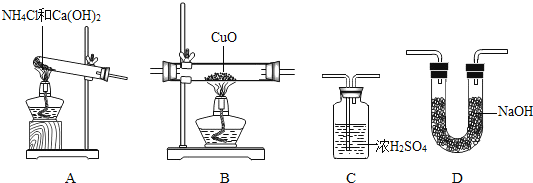
����Ŀ��С�մ���Ҫ�ɷ�ΪNaHCO3���г����������Ȼ��ƣ���ѧС���ͬѧΪ�˲ⶨС�մ���NaHCO3����������������������ʵ�飺����Ʒ�����ձ��У������������μ�ϡ���ᣬ�����ٲ�������Ϊֹ����õ��й��������±���ʾ��
�� �� | �� Ʒ | ����ϡ�������� | ��Ӧ����Һ���� |
������g�� | 9 | 75.4 | 80 |
���㣺
��1����Ʒ�е�NaHCO3����������
��2��������Һ�����ʵ�����������